干货分享丨全血/血浆/血清/红细胞中脂肪酸检测
在科研工作中,你是不是也曾被这个问题困扰?
在调研文献的时候,明明都是测脂肪酸,有的文献是测全血,有的是血浆,有的是血清,甚至还有测红细胞的?到底哪种样品类型最合适?
好不容易确定了这个问题,检测方又抛出了一个新问题,是要测总脂肪酸?还是测游离脂肪酸?大脑CPU都要被烧干了,这两者又有什么区别?
接下来,我们用最具学术精神的回答,溯源每个问题的本真。
各种类型血样的权威定义?
全血(Whole Blood):采用特定的方法将符合要求的献血者体内一定量外周静脉血采集至塑料血袋内,与一定量的保养液混合而成的血液制剂(GB 18469-2012、WS/T 203-2020)。全血制剂的成分与体内循环血液成分基本一致,采集后随着保存期的延长,全血中血小板及不稳定凝血因子逐渐失去生物学活性。目前临床应用较少,主要用于制备成分血(《全血和成分血使用标准释义》)。上面是献血相关标准中的严格定义,在临床和科研实践中,有用抗凝采血管收集外周血的,也有用滤纸片收集末梢血的,也有用毛细管收集动物眼眶后静脉血的。
血浆(Plasma):血浆是血液的非细胞成分,含有水分、无机物、糖类、脂类和蛋白质等。血浆中的蛋白质主要包含白蛋白、免疫球蛋白、凝血因子及纤溶蛋白等(《全血和成分血使用标准释义》)。
血清(Serum):血凝块会发生收缩析出的淡黄色液体,称为血清(《生理学》)。血清与血浆的主要区别是前者不含纤维蛋白原(WS/T 225-2024)。
红细胞(Red Blood Cell):红细胞是血液中的一种无核细胞,正常红细胞呈双凹面盘状。红细胞是运送氧气最主要的载体(《全血和成分血使用标准释义》)。血清和血浆中均不含有红细胞。
如何制备这些血样?
全血:全血标本的采集同血浆标本。全血需尽快分离,未分离的全血在常温放置会影响其稳定,稳定时间不超过2 小时(WS/T 225-2024)。注意,全血样本不需要离心,按照临床标准采集的全血样本中含有抗凝剂。
血浆:当检测标本类型为血浆时,应使用含有抗凝剂的采血管,在标本采集完成后应立即进行充分混匀,以避免纤维蛋白丝、微小凝块及血凝块的形成,同时应避免混匀力度过大造成的血细胞损伤/溶血、血小板激活或凝血的发生。抗凝标本可以立即离心。实验室应针对所用离心机的类型咨询采血设备制造商关于离心速度和时间的建议。RCF是比RPM更有意义的指标,实验室宜根据RCF规定离心的要求,并核查在规定离心条件下采血管凝胶屏障的完整性(WS/T 225-2024)。在此之前旧标准建议RCF为1000g~1200g,离心时间为5~10min(WS/T 225-2002)。注意,检测同一项目的血浆,需要使用相同的抗凝剂。
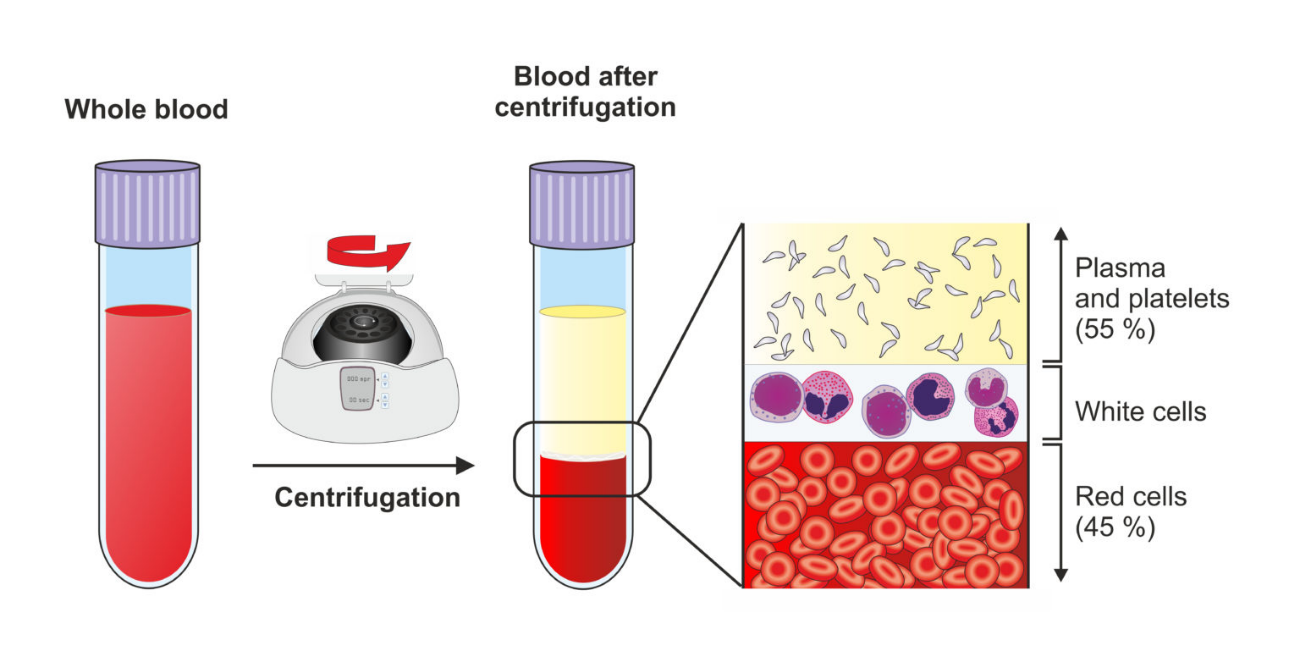
图1 全血和血浆样本的制备和区别
血清:标本在离心前应保证血液凝固充分,不可手工剥离凝块。通常在室温下放置30分钟至60分钟可完全凝固,37 ℃水浴可加速血液凝固,冷藏会延迟血液凝固,使用含有促凝剂采血管可明显缩短血液凝固的时间。如果患者接受抗凝治疗,则血液凝固时间会延长(WS/T 225-2024)。关于离心的部分同血浆。注意,血清样本一定没有抗凝剂。

图2 血清和血浆样本的区别
红细胞:红细胞成分主要来源是全血采集后经离心分离,也可通过血细胞分离机采集制备。常见红细胞成分包括悬浮红细胞、浓缩红细胞、洗涤红细胞和冰冻解冻去甘油红细胞等。红细胞成分也可通过去白细胞处理为去白细胞红细胞,通过辐照处理成辐照红细胞(《全血和成分血使用标准释义》)。不同红细胞成分的制备可以参考GB 18469-2012。注意,冻存后的全血样本无法再提取红细胞,因为全血解冻后易发生严重溶血(红细胞冻融过程细胞膜涨破)。存储的红细胞样品要尽可能去除水。
红细胞压积(Hematocrit,HCT):红细胞比容,也可简称为PCV(packed cell volume,PCV),是指在一定条件下,经离心沉淀压紧的红细胞占全血的容积比,是一种间接反映红细胞数量、大小及体积的表示方法《全血和成分血使用标准释义》。简单来说,将少量抗凝血加入毛细管中,高速离心后,测试管各界面读数来计算比容(WS/T 342-2011)。注意,需要使用新鲜的全血检测红细胞压积,冻存后的全血会发生溶血。
干血斑(Dried Blood Spot,DBS):使用尖头器械穿刺或切开皮肤以获取毛细血管血液(通常称为末梢血),包含来自小动脉、小静脉、间质和细胞内液体的未知比例的血液混合物。皮肤穿刺采血常用于儿科患者少量血液标本的采集,还可用于滤纸收集、床旁检验等标本的采集。手指是成人和年龄较大儿童常用皮肤穿刺部位,对于新生儿和婴儿宜进行足跟采血制作干血斑(WS/T 225-2024)。也可以在样本运输、保存困难的情况下也可用于成人样本的采集。将采集的各种血液样品制备成滤纸干血斑,最常用的是用抗凝全血、外周全血和血浆制备滤纸干血斑。用移液器吸取100μl抗凝全血(或血浆)样品,对准滤纸印圈的中心处,将样品滴在滤纸上,或将穿刺后自皮肤伤口流出的外周全血直接滴加在滤纸印圈的中心处。在室温下自然干燥至少4h(潮湿气候下至少干燥24h),血斑充分干燥后,将其放入密封袋中(《艾滋病性病防治》)。注意,干血斑可能是末梢血,也可能是全血,甚至可能是血浆。但是检测同一项目的样品,需要保持一致。
血样的保存条件和时间?
在文献检索的过程,我们发现一篇2016年的“重量级”的综述(DOI: 10.1016/j.plefa.2015.12.003),基本上对各种类型的样本的保存温度、时间、是否加保护剂等条件进行了全方位的排列组合(Table 1~4)。感兴趣的同学可以下载全文对照一下自己的样本的收集和保存过程。
对于血清和血浆样本,室温下不要暴露超过6个小时,4度可保存6天,-20度可保存1~3年,-80度保存时间可以长达10年。
红细胞没有跨度这么长时间的研究,其中最长的是-80度保存4年,-20度下可以保存90天,但是与温度相比,影响更大的是液体的量,存在越少的水越有利于保存。
在微量管中的全血样本相对稳定性较差,室温和-20度下仅能保存3天,4度反而能保存30天,在-75度的条件下则能存储180天。使用滤纸片的全血样本(干血斑)需要注意密封保存,如果有条件,还可以适当添加BHT作为保护剂。如果要长期保存,还是推荐-75度条件。
简述一下,对于所有样本类型,最佳的条件是-80度保存。主要是多不饱和脂肪酸(PUFA)会在Fe3+和氧的作用下发生过氧化从而导致损失,因此在样品收集过程中要尽可能减少较高温度(如室温)暴露时间、避免开放式放置、避免多次冻融。
当然,也会有文献提出不同的看法,例如2016年的另一篇文章(DOI:10.1016/j.clinms.2016.12.001)提出血清、血浆样品在室温下24小时,在4度下至少7天,在20度下至少75天,并且3次冻融循环均稳定。考察的指标也包括PUFA,但是关于室温下的暴露时间,明显跟综述有较大区别。
测脂肪酸用哪种类型的血样?
事实上,测每种类型的都大有人在。有篇文章(DOI:10.1016/j.plefa.2007.05.003)还专门比较了血浆、红细胞和全血中脂肪酸的主要存在形式、PUFA、n-3 Index等。发现血浆和脂蛋白中的脂肪酸谱具有一定可比性,但是与红细胞中的完全不可比。如果要下一个结论,就是脂肪酸谱的结果仅能同类型样本相比较。
在这篇文章的提示下,我们公司使用4位志愿者同时间点采集的血清和血浆样本,进行了一次脂肪酸定量检测,发现检测到的脂肪酸种类一致,数值上血浆中的脂肪酸浓度普遍高于血清,但是这种差异并不显著。当然,由于我们实验的例数较少,这个结果可能不具有普遍性。
这几年,测红细胞中脂肪酸的文章不少,而且往往都是用大队列研究重大疾病的相关性、早筛早诊、发病机制等,这又是为什么呢?原来血清、血浆中的脂肪酸受膳食摄入影响较大,而红细胞因为具有较长的半衰期(120天),被认为能更好地反映机体中长期(3周~3个月)脂肪酸摄入状况,尤其是人体不能合成的必需脂肪酸如n-3脂肪酸(DOI:10.1016/j.plefa.2007.05.003)。所以在营养干预的研究中,测红细胞的更多,要定量检测红细胞中脂肪酸,除了需要使用新鲜的全血样本分离红细胞,还需要记录全血的体积,并检测红细胞压积来用于定量计算,单位往往是ng/mL或nmol/L。有的科学研究中也直接使用红细胞体积用于定量计算。但是,这并不意味着血清或血浆就不适合测脂肪酸,采血前务必空腹。
测总脂肪酸还是游离脂肪酸?
在生物体内大部分脂肪酸都以结合形式,如甘油三酯、磷脂、胆固醇酯等存在,少量脂肪酸以游离形式存在(DOI:10.1152/physrev.00041.2018)。这些未与甘油、胆固醇等酯化的游离脂肪酸(Free fatty acids, FFA),又可称为非酯化脂肪酸(Nonesterified fatty acids, NEFA)。正常情况下,血样中游离脂肪酸的含量极少,仅占总脂肪酸的5%~10%(主要包括油酸、棕榈酸、硬脂酸等)。血样中的脂肪酸,大部分以甘油三酯、磷脂、胆固醇酯等存在于脂蛋白中,而脂蛋白浓度极易受饮食影响。
如果要检测total(总)的脂肪酸,是结合形式和游离形式之和。样品制备过程使用酸水解酯键,再对羧基进行衍生化,GC-MS检测。
如果要检测free(游离)形式的脂肪酸,样品制备过程不能使用酸或碱水解酯键,而是直接对羧基进行衍生化,GC-MS检测。
关注营养摄入、脂质代谢、MUFA、PUFA、n-3 Index的建议检测总脂肪酸,而目标明确仅关注某一种脂肪酸的变化及机制研究的建议检测游离脂肪酸。取决于研究的具体目的和需求,并没有完全绝对的结论。
参考文献:
1.GB 18469-2012全血及成分血质量要求
2.WS/T 225-2024临床化学检验血液标本的采集与处理
3.WS/T 225-2002临床化学检验血液标本的采集与处理
4.WS/T 203-2020输血医学术语
5.WS/T 342-2011红细胞比容测定参考方法
6.《全血和成分血使用标准释义》,人民卫生出版社,中国医学科学院输血研究所,刘忠
7.《生理学》,中国中医药出版社,施建蓉、赵铁建
8.《艾滋病性病防治》,复旦大学出版社,杜占声
9.《艾滋病全程管理与综合治疗实践》,人民卫生出版社,刘寿荣、戚建江
10.The stability of blood fatty acids during storage and potential mechanisms of degradation: A review
11.Fatty acid composition of plasma, blood cells and whole blood: Relevance for the assessment of the fatty acid status in humans
12.Free Fatty Acid Receptors in Health and Disease



