最新综述丨Signal Transduct Target Ther生物标志物中的小分子
代谢表型
代谢异常导致的代谢途径和代谢物功能紊乱是很多疾病的重要特征。代谢物特征可以用于疾病的诊断、预后预测和治疗效果的监测。早期生物标志物的缺乏对疾病的诊断和治疗都非常不利。因此,发展用于诊断和监测的高特异性、高选择性的无创方法非常有必要。代谢组学已经成为发现代谢生物标志物和代谢物途径分析的专业工具,可以发现多种疾病的潜在机制和治疗靶点。代谢组学可以帮助鉴定与表型变化相关的功能性生物标志物,发现生化途径变化,这些变化可以作为疾病早期诊断的辅助指标。最近,研究者已经进行了大规模的代谢组分析以期发现生物医学治疗中的潜在靶点。2023年3月,发表在nautre旗下的STTT上的这篇Review总结了基于代谢组分析发现的小分子代谢物作为临床诊断、预后标志物的潜力,在药物筛选和治疗中的应用以及下一步突破所面临的挑战。文章标题为“Small molecule metabolites: discovery of biomarkers and therapeutic targets”,原文链接:https://doi.org/10.1038/s41392-023-01399-3。
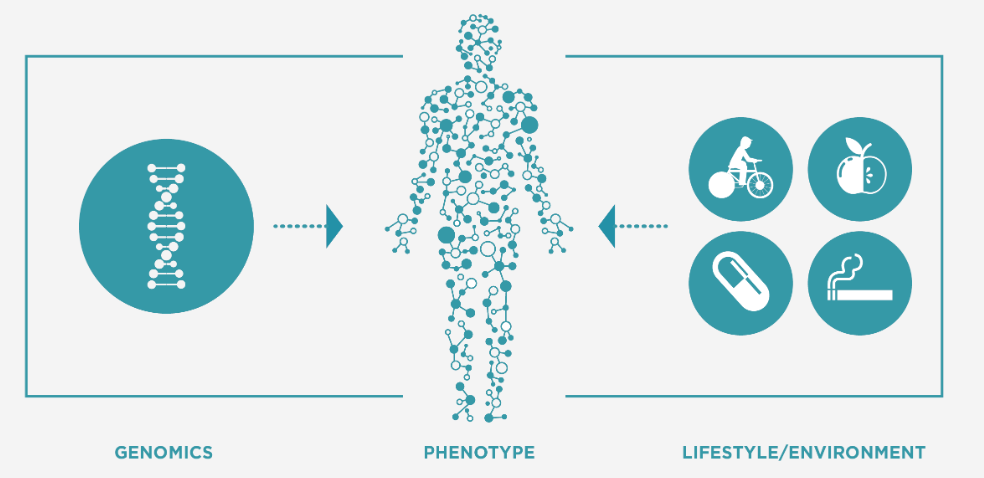
来自人体生物体液的代谢物生物特征提供了基因型、环境和表型之间的联系,是具有吸引力的用于临床诊断、预后和疾病分类的生物标志物。差异代谢物可以提高患者诊断、监测、风险预测和预后的特异性和准确性。发现和鉴定小分子代谢物和代谢物途径的改变对理解疾病的病理过程以及治疗靶点的鉴定都非常有帮助。代谢组学技术的已经发展成为一种有效的无损、高通量检测方法。主要方法包括代谢表型、代谢指纹、代谢轮廓和靶向代谢物分析。
01 先进的技术平台
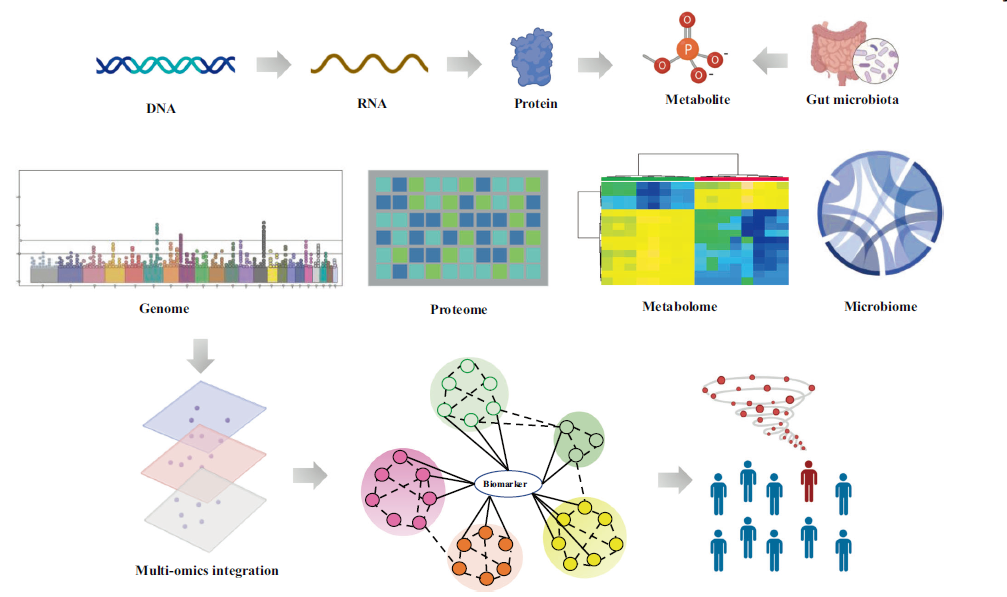
作为下游产物,小分子代谢物与特定的代谢表型相关,代谢组研究可以为疾病的机制研究和治疗靶点的发现提供新的见解。代谢组主要包括分子量小于1500 Da的小分子物质。所有代谢物的水平都受生理活动和外源性环境因素影响,这使得代谢组学数据的解释更为困难。技术的突破为探索疾病的代谢维度提供了新的契机,代谢组检测的主要技术包括磁共振(NMR)和质谱(MS)。MS可以检测低丰度的代谢物,最近正在发展空间分辨率的代谢物检测技术。高通量的质谱成像技术可以同时检测多种代谢物的空间分布,为理解复杂的交互网络提供了具有吸引力的平台。NMR主要用于生物标志物的表征和多种疾病的分类。目前,还没有单一方法可以胜任检测整个代谢组的任务。
代谢组学可以分为靶向代谢组学和非靶向代谢组学。非靶向代谢组学可以揭示以前未知的代谢信息,而靶向代谢组学则只分析一组代谢物,比非靶向代谢组学更灵敏,重复性也更好。由于代谢组的复杂性,数据分析需要对原始数据进行预处理,然后再进行多变量分析,组学数据挖掘和生物信息整合。较大的数据集需要专业的工具进行快速分析。自动注释和数据库建立等技术的进展可以解决这些问题。HMDB和KEGG是代谢物分析常用的数据库,生物信息学工具可以自动处理代谢组数据。比如,MetaboAnalyst工具可以分析产生相互作用网络和可视化图,包括使用网络拓扑方法进行多种通路分析和代谢物富集分析。
内源性代谢物由宿主和体内微生物合成,小分子代谢物可以通过分解代谢或合成代谢产生,比如肽、糖、氨基酸、核酸、有机酸、脂质和脂肪酸。代谢物是基因型和表型之间最为紧密的联系,反映了基因组、蛋白质组、转录组、表观基因组,以及其与环境的相互作用。一旦与疾病病理生理相关的特定代谢物被鉴定出来,人们会进一步研究生物标志物相关的机制通路,并采用无创的方法来监测疾病的发展和区分患病人员。由于代谢组的化学复杂性和动态范围,同时鉴定和可靠定量代谢特征非常复杂。生物标志物的鉴定能促进疾病的诊断和预后判断、个体化治疗,能更好的理解和探索疾病发展或者药物调节相关的潜在分子途径和机制。鉴于代谢轮廓的改变,小分子的定性和定量研究技术为鉴定有潜力的生物标志物和预测模型提供了绝佳的机会。
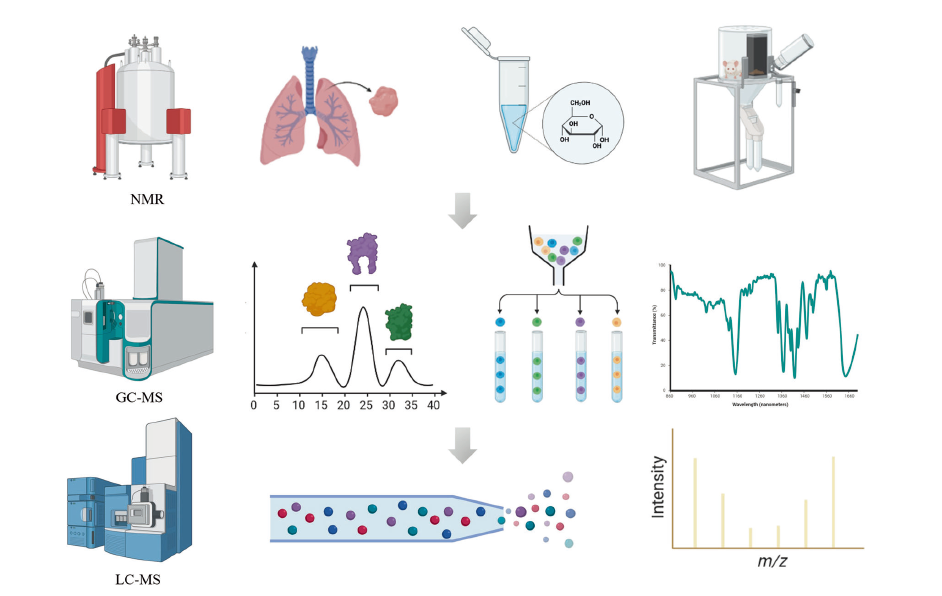
主要用于检测小分子的分析平台包括NMR、LC-MS和GC-MS。每种技术在灵敏度、准确度、分辨率、动态范围、重复性和通量方面都有其独特的优势。基于质谱的方法可以检测一系列生物活性代谢物。MS扫描、高精度MS/MS分析与数据库(比如HMDB和METLIN)相结合可以提供大量的相对离子丰度,获得更可靠的鉴定。此外,高度复杂数据还需要分析软件来完成代谢物的鉴定和代谢通路分析。XCMS Online、Open-MS、MZmine和MS-DIAL软件可用于峰检测和校准。
NMR数据处理可以使用NMRbox来完成代谢物鉴定。软件工具和大量的谱图数据库有助于通过一维NMR和二维NMR谱图进行代谢物鉴定。然而,结合核磁共振和质谱数据极大地提高了代谢组的覆盖率,并增强了代谢物鉴定的准确性,有利于提高数据质量。
很多研究组致力于开发在线工具用于统计和生物信息分析,比如Metlin、MetaboAnalyst和KEGG。相关性分析反映了代谢物与临床特征之间的关联性,并进一步评估了潜在的代谢差异。为了找到一组代谢物作为某种特定情况下的可能生物标志物,每个代谢物需要进行独立分析来确定其诊断能力。根据最新的HMDB 5.0数据的信息,一共有24368种代谢物被发布。尿液和血液中分别检出了5661和38036种代谢物。近几十年来,在疾病的发展中,许多相关小分子代谢物已经被发现,这些研究需要强调代谢物的生物活性,并提供它们相关的生物学意义。
02 探索表型特征
了解每一个病人,而不是所有病人平均的代谢图谱表征将有可能用于精准治疗。代谢轮廓是许多不同代谢物的集合,可以使用小分子代谢物作为指数来描述人类表型的生化状态。具体代谢表型的阐明对于鉴定潜在的生物标志物和药物靶点,以及更好的理解潜在的病理机制都至关重要。
病人的代谢轮廓是动态变化的,受生活方式、疾病、外部或内部刺激、生理和病理情况变化影响。生物体液的代谢轮廓可以直接反映不同组织和器官的特定代谢状态,也可以决定不同病人亚组的代谢特征。代谢变化作为早期诊断和潜在治疗的生物标志物靶标,对调节新陈代谢起显著的病理作用。
03 有前景的生物标志物
根据NIH的标准,生物标志物定义为可以测量作为生理、生物、病理或者药理过程指标的特征。生物标志物具有可以量化、可检测和与人类表型相关的特征;可以用于早期诊断,提高治疗效果和治疗策略的合理性,并且能降低与疾病相关死亡率,有助于发现新的治疗靶点。目前临床使用的生物标志物仍缺少足够的灵敏性和特异性。因此,要提高患者的管理水平,需要发现更精准的体液生物标志物。
近年来,人们发现了多种生物标志物用于早期疾病发现和预测疾病进展、临床结局或药物反应。生物标志物可以是一组代谢物、一种代谢物或者一种分子特征。疾病的出现表明代谢物浓度的异常是系统代谢通路稳态受到破坏的一种征兆。因此,与蛋白质和基因不同,代谢物作为生化活性特征与人类表型密切相关。
由于诊断不准确和对病理生理过程的了解有限,代谢紊乱的精准治疗仍然是一个巨大的挑战。研究小分子生物标志物对精准治疗非常必要。建立生物体液的内源性代谢生物标志物的定量指纹图谱有助于建立疾病进程和代谢变化之间的密切关系。目前,使用特定代谢物特征对处于初始阶段的疾病进行快速检测仍然面临巨大挑战。先进的平台,特别是使用LC/MS/MS,有助于小分子代谢物的检测、定量和表征,并且很大程度上提高了它们的转化能力。
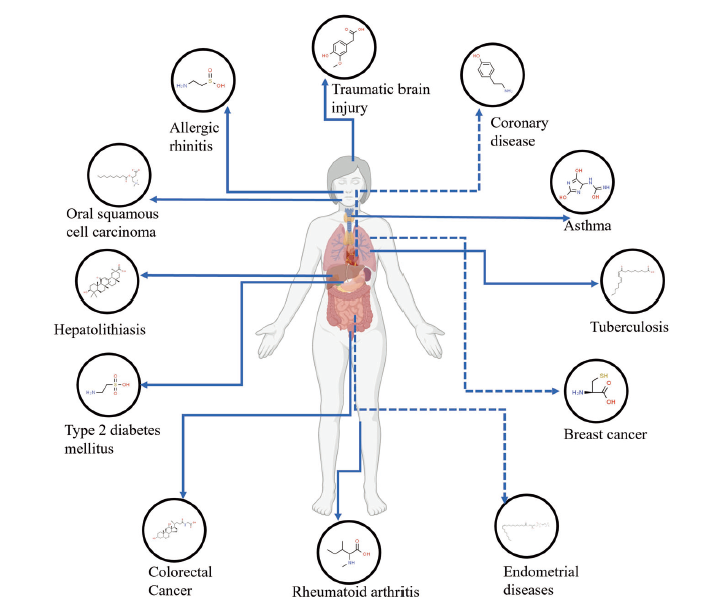
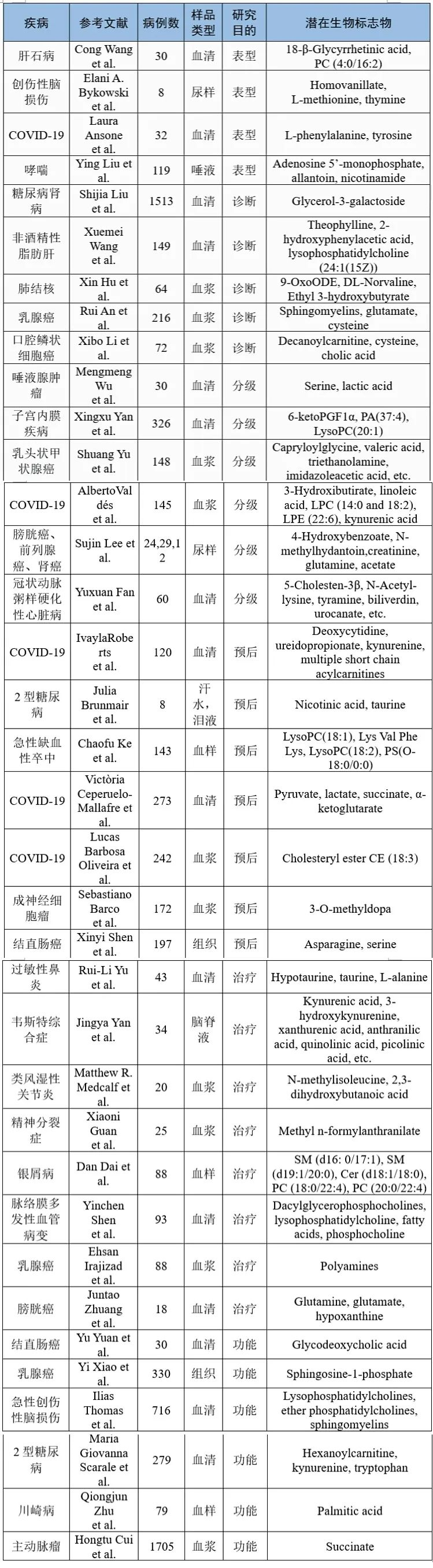
目前筛选出来的一些有代表性的潜在生物标志物总结出来。六种代谢物的组合(β-丙氨酸、同型丝氨酸、3-羟基犬尿氨酸、天冬氨酸、酪氨酸和鸟氨酸)被量化为潜在的血液生物标志物,被认为是帕金森疾病诊断和预后的潜在分析方法。循环代谢物:谷氨酰胺、酪氨酸、脯氨酸、组氨酸、丙氨酸和柠檬酸与乳腺癌发展有显著相关性。一个由两个潜在预测血清代谢物(棕榈酰胺和去氧胆酸)被报道为克罗恩病患者的潜在生物标志物,它的代谢紊乱包括脂肪酸,胆汁酸生物合成和能量代谢。此外,随着相关分析和ROC曲线分析的使用,特征代谢物包括丙氨酸、葡萄糖、乳酸、甘氨酸和苏氨酸在肺动脉高压患者中被鉴定出来,苏氨酸和乳酸与肺血管阻力和动脉压显著相关。5-氧脯氨酸可以作为急性缺血性休克的重要生物标志物。小分子代谢物包括LysoPC(15:0)、二十二碳五烯酸、丙基肉碱、LysoPC(14:0)和苯丙氨酸为代谢异常和代谢综合征的危险因素。据报道,与Akt相关的候选生物标志物花生四烯酸和13(S)-HODE是非小细胞肺癌的潜在生物标志物。
及时诊断是至关重要的,小分子代谢物的筛查可能在疾病诊断中起到关键作用。小分子代谢物是生理过程的末端产物,因此探索整个代谢组可以更好的了解疾病病理和干预机制。组学方法结合模式识别可以用于早期疾病诊断生物标志物的发现。
04 疾病分类和分级
临床医生需要快速并准确地评估疾病分级的风险。近来,多种组学结合的方法作为一种很有前景的方法检测早期代谢变化,可能会用于疾病分类、分级和进展评估。选择合适的与病理状态相关的代谢物有助于做决定,降低从探索测试到临床的花费。内源性代谢物筛选结合传统风险评估可以在出现症状之前发现代谢表型的变化,具有提高无创诊断和疾病分类的潜力,很有希望走向临床。代谢物指纹具有预测疾病风险的能力,大数据结合人工智能或者大数据挖掘将对疾病分级分析具有重要意义,可以作为一个智能工具帮助临床医生做决定。
已经有大量的队列研究去帮助建立更有效、更可靠的用于疾病分级危险事件的评估模型。肌酸、脯氨酸和棕榈酸在胰腺导管腺癌与良性组织的区分中表现出一定潜力。一些小分子代谢物,比如吲哚丙烯酸、酪氨酸、视黄醇、辛烷基肉碱和癸烷基肉碱被发现有较高的AUC值,表现出较好的能力区分肺转移癌症和其他亚型。代谢组和脂质组整合分析发现D-甘油酸、皮质醇、2-(甲基硫代)乙醇、N-乙酰组胺可以构建模型用于鳞状癌和非小细胞肺癌的精确病理分类。丝氨酸和乳酸建立的模型可以预测唾液腺肿瘤的良性和恶性程度。两种尿液代谢物皮酮四醇和四氢可的松对髓母细胞瘤的诊断和检测表现出较高的准确性。使用三磷酸硫胺素、糖尿病持续时间和收缩压建立的诺模图可以用于糖尿病视网膜病变的早期诊断和精准预测。氨基酸、能量、脂质代谢的改变能区分稳定型和不稳定型冠状动脉粥样硬化心脏病。基于高分辨率质谱的组织空间代谢组学用于胃癌亚型分类。尿液代谢物N-甲基乙内酰脲、4-羟基苯甲酸酯、肌酐、乙酸和谷氨酰胺区分前列腺癌、膀胱癌和肾细胞癌具有较高的准确度。此外,代谢物或者代谢物组合在鉴别甲状腺乳头状癌与良性癌,区分新冠早期和终末期,鉴别子宫内膜息肉与内膜增生或者子宫内膜癌方面以及其他疾病的诊断和分级中均表现出极大的潜力。
05 实现精准治疗
没有一种特定的治疗方法可以满足所有的病人需求。因此,通过预测治疗效果,给予每个病人合适的治疗是临床所必需的。新的技术对发现有效的和有潜力的用于指导病人管理的生物标志物至关重要。代谢物轮廓分析可以系统的分析代谢物,用于预测和监测药物治疗的反应,发现药物靶点,个体化治疗以减轻疾病负担。代谢特征可以为靶向代谢途径或者精准药物治疗提供大量的信息。独特的代谢物特征对鉴定不同的治疗反应非常有用(Table 1)。
06 代谢网络研究
大多数天然产物通过影响多个而不是单个靶点发挥生物活性。代谢组学已被用于检测生物样品中意想不到的代谢变化,了解代谢过程和探索网络靶点和机制。此类分析过程总是产生越来越复杂的大数据集,导致处理、分析和解释小分子代谢物之间的关系成为主要的挑战。小分子代谢物的关联信息关系的生物学解释可以总结为基于已知的代谢网络。在代谢网络中,特征代谢物作为节点,而相关代谢物做为边连接起来。整合多层网络将有助于提高代谢物的鉴定,衍生出新的生物学解释。一旦共同调节代谢物的代谢网络被建立起来,就可以使用先进的算法对代谢信息进行挖掘。最近使用多网络构建和基于图形的方法来执行拓扑分析聚焦于代谢过程或感兴趣表型相关代谢物数据的发掘。根据所鉴定的代谢物的相似性或相关性,图形分析、先进的统计方法和数据分析可以用来探索相互关联的数据,揭示代谢物在生物样本中关系。过去的几年中,面向多靶点化合物的基于网络的方法已成为重要的工具,因其具有确定和研究新药靶点和复杂关系的潜力。“网路药理学”专注于从“一个靶点一个药物”的理念向“靶点网络组成”转变,进而对抗复杂疾病。生物信息学和高通量筛选方法有助于各种药物靶点网络的预测,对揭示药物作用机制越来越重要。对不同代谢途径的系统分析来鉴定新的靶点可能克服现代药物设计的陷阱,有助于理念的转变,开发新的诊断和靶向治疗工具。
07 疗效评价
代谢组学在发现用于评估治疗效果的生物标志物方面发挥着重要作用。深入研究小分子代谢物可以指导药效评估,药物开发和药物安全性评价。选择最有效的治疗药物是非常重要的。在用药之前,鉴定小分子代谢物作为与药物反应相关的生物标志物将极大降低治疗的经济成本。这与我们需要筛选代谢物用于确定每一阶段的治疗效果和发展更有效的治疗策略的理念一致。血中犬尿氨酸水平的降低可能提示艾司西酞普兰的治疗反应,提示它可能参与艾司西酞普兰治疗导致重度抑郁的病理生理反应。血清代谢产物包括精氨酸和花生四烯酸可以作为乳腺癌的诊断性生物标志物,预测曲妥珠单抗的治疗效果。药用植物通常依赖于复杂的成分,是治疗代谢紊乱的重要资源。然而,由于复杂组分和多分子靶点,草药和复方药的作用分子机制仍不清楚,常规方法对药物疗效的评估不够灵敏。关于中草药调控代谢的机制可以帮助预测和理解药物的功效和毒性。研究表明,代谢组学可以进一步用于鉴定活性化合物和靶点来助力新的治疗方法的开发。
08 活性成分发现
在过去的几十年里,有一半以上的新药和药物先导化合物都是从天然产物中提炼出来的。在临床上,草药产品与常规药物联合使用可以改善药理作用。由于其复杂性,天然产物中的活性成分或者药物先导物的鉴定一直具有挑战性。虽然已取得重大进展,发现新的活性成分的一个主要挑战是药理机制不清楚。药用植物如草药提取物、复方制剂和不同的化合物通过调节代谢紊乱和机制途径来发挥药理作用。高通量代谢组学符合中草药复杂疗效的整体观点和机制见解。探索草药衍生的生物活性成分对机制研究、代谢通路改变和发现代谢疾病的治疗靶点尤为关键。
由于天然化合物具有靶向代谢的能力和多样的结构,其作为潜在的治疗制剂越来越引人注意。各种草药衍生的生物活性化合物可以针对代谢调节机制并表现出治疗潜力。高分辨率预测技术或可视化方法增强了筛选和验证天然先导化合物的能力。生物活性化合物可以在特定表型中靶向小分子代谢物相关的代谢过程,调节不同途径的代谢活动,对高度复杂疾病的治疗具有重大潜力。
09 活性成分的代谢过程
来自草药的植物化学物质作为天然产物具有健康效应已经广为人知,但是它们的活性和潜在机制仍有待深入研究。为了研究植物化学物质的药理作用需要重点解决如下问题:如何检测低含量的活性成分;如何阐明代谢途径;如何揭示体内总体代谢过程和效应机制。整个过程非常复杂,因为体内有大量的代谢反应,同时产生多种代谢物。体内代谢过程研究对确定药效的多成分特点和指导新药研发,或加速从天然产物中发现新药都非常重要。由I相和II相反应以及肠道菌群介导的生物转化直接影响药效,对确定活性成分的药代动力学参数至关重要。体内代谢参数,包括Cmax, Tmax, t1/2, and AUC0-t为最常用的参数。
由于现代质谱与色谱串联分析技术具有较高的灵敏度和稳定性,其在研究活性成为体内代谢过程中发挥着举足轻重的作用。非靶向代谢组学筛选策略重点关注体内代谢物在给药组和空白对照中的差异,进而探索剂量-效应关系。选择与治疗效果相关的体内代谢物作为药理学指标来反应整体药效具有重要意义。由于有效成分的复杂性和对效果贡献权重的不同,有必要在体内进行研究多种活性成分组合的代谢过程,从而可以指导临床实践。基于建立的体内代谢网络,与小分子代谢物高度相关的活性成分标志物可以通过分子网络技术有效地筛选出来。活性成分适当的混合可以通过代谢表型筛选被优化,其靶点和分子机制可以通过网络药理学、人工智能或计算机对接来揭示。
10 代谢稳态和肠道菌群
越来越多的证据表明,体内平衡依赖于与肠道菌群的相互作用。肠道菌群可以产生多种代谢物作为宿主和微生物之间的信使。肠道微生物群作为一个“看不见的器官”,通过它们的受体信号来调节产生活性代谢物进而影响宿主的新陈代谢。肠道菌群紊乱可以影响各种器官,导致代谢疾病。肠道菌群失衡与疾病机制密切相关,这意味着调节肠道菌群是一种新的治疗方法。肠道菌群作为一个不可或缺的“器官”可以调控药物代谢,影响其生物利用度和治疗效果。天然产物可以改变肠道菌群构成和其代谢物,这一过程在药物研发时可以增强药效并减少副作用。天然产物主要在肠道中被代谢和吸收,次生代谢物可调节代谢扰动。
肠道菌群通过体循环来影响宿主血管的病理过程和能量稳态。菌群失衡导致的能量代谢紊乱在疾病发展中起关键作用。比如,短链脂肪酸可以激活细胞信号通路对调控能量代谢发挥有益作用。肠道菌群与胆汁酸的相互作用作为信号调节因子对疾病进展有深远影响(图3)。肠道菌群可以产生多种小分子代谢物,它们作为信使分子在维持宿主稳态和影响疾病状态中发挥重要作用。有一些代谢物只能由肠道菌群产生,肠道菌群可以代谢初级胆汁酸,对肠道疾病具有保护作用。代谢生物标志物可用于分析肠道菌群构成与代谢之间的相互作用。
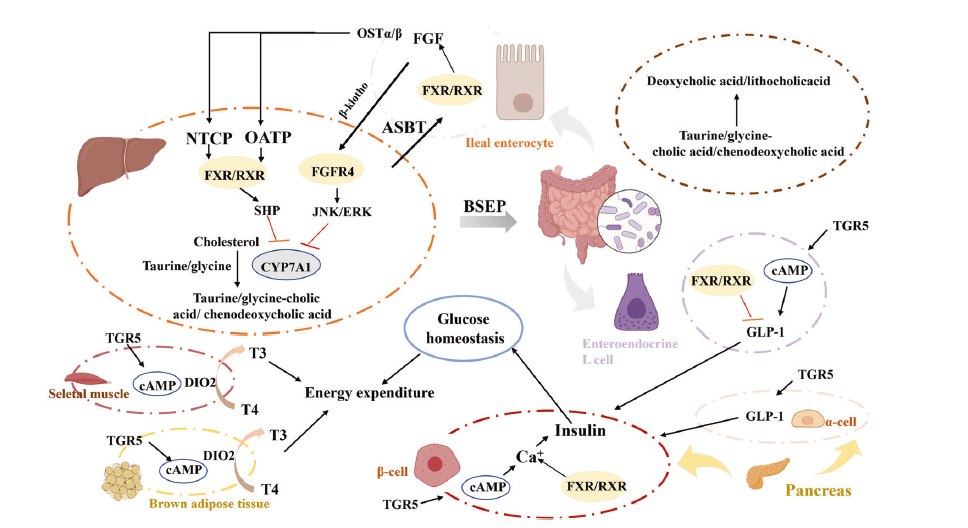
胆汁酸与肠道微生物相互作用参与宿主代谢
11 影响因素
代谢受各种内源和外源因素影响,代谢物也受性别、年龄、体重、营养、药物、生活方式和昼夜节律的影响。这些因素难以监测,可能是代谢生物标志物研究中最具挑战性的原因。虽然潜在的代谢标志物用于诊断和治疗的筛查取得了很大进展,但其可行性还需要大量的队列研究验证。代谢物在人类和实验动物之间的差异也应予以考虑。代谢组受遗传因素、肠道菌群和环境暴露影响。代谢组学与基因组学、蛋白质组学或者转录组学不同,可以快速准确地反映出生物体清晰的表型状态,但它受外部混杂因素的影响。
12 展望与结论
代谢组学是一门相对年轻的学科,目前检测方法代谢物的覆盖范围仍然有限,使得最终结果的解释不充分。因此,多种检测平台的有机整合和其他组学数据的整合分析是未来主要的发展方向。然而,由于代谢途径的复杂性和数据与代谢网络之间的相互作用,多组学数据的整合仍是一个巨大的挑战。由于代谢标志物易受环境因素影响,仍然很难在保持代谢物原本代谢状态下对其进行快速分离。需要提高检测精度和准确度来实时分析整个代谢组。打破技术瓶颈来提高代谢组检测的覆盖度、灵敏性和准确性仍需要大量的努力。未来研究应重点解决如何整合疾病代谢表型,并将其用于临床诊断和治疗。大型前瞻性临床试验可以验证发现的具有较高转化机会的小分子代谢物。为了更好的研究表型背后的机制,未来的挑战将包括不同数据集的标准化、检测方法的标准化以及新算法的开发等。借助强大的人工智能或大数据分析、机器学习的帮助,可以更好地理解病理途径和代谢相关疾病的机制,为临床决定提供切实可行的方法,加快代谢物和代谢表型在临床应用中的进程。了解代谢物的空间信息对疾病的理解也非常重要,高分辨率的代谢成像技术也将是未来发展的重点之一。
异常代谢物可作为潜在的生物标志物评估诊断和监测治疗反应和预后,将为今后的精准医学提供充足的依据。疾病中人体多种代谢途径发生改变,其可能是进一步临床试验潜在的靶点。代谢组提供了一个全面、动态和精确的代谢表型,可以赋予个性化临床实践。众多研究在进行基于代谢组学的发现,识别独特的代谢特征,有助于了解生理或病理生理过程中的复杂代谢物网络。可以预见的生物医学应用包括监测健康和疾病,评估疾病严重程度或药物开发,预测时间进程,监测疾病进展,预测潜在的治疗方法,并加以阐明疾病机制。接下来的研究应该提高潜在生物标志物的诊断和预测能力。另外,未来的方向是解决临床应用相关的问题,比如建立代谢谱与临床参数之间的关系。今后的努力还应增加代谢物鉴定的可信度,确定代谢生物标志物的临床可应用性,为未来精准医疗开辟新径。



