干货分享丨代谢组学探究抑郁症与肠道菌群的相互作用
抑郁症的简介及其治疗
抑郁症(Major Depressive Disorder, MDD)是一种以情绪低落、兴趣减退、思维迟缓、悲伤消极、无价值感和负罪感等主要临床特征的慢性精神障碍疾病,常伴有食欲不振、疲劳感增加、失眠、注意力不集中等症状。是全世界致残能力最强的精神疾病之一,成年人群终生患病率约为20%,具有高发病率、高死亡率、高漏诊率等特点。而MDD作为一种复杂的精神类疾病,目前发病机制尚不可知,其病因和临床表现多种多样,不同亚型之间存在明显的异质性。临床上对MDD的诊断主要依赖于医师对患者的症状表现进行诊断评估。这种诊断方法受临床医师的经验及患者自身的主观因素等影响,导致不能对MDD进行准确有效地识别,并不能准确有效的诊断MDD。

图1 抑郁症早期症状
目前临床上对MDD的治疗仍然以药物治疗为主,使用的大多数抗抑郁药是基于“中枢神经系统单胺类神经递质传递功能下降”的致病机制研发的,通过不同途径提高神经元突触间隙单胺类神经递质浓度,以期达到治疗目的。除了药物治疗,临床上还采用其他物理治疗方式,如心理治疗、磁性劫持疗法(MST)、电休克疗法、经颅磁刺激疗法(TMS)等和药物相结合的办法治疗MDD。心理治疗往往是缓解病人的消极、自卑、绝望等情绪,从而使患者恢复日常生活和社会活动。此外,适当的体育锻炼可以帮助人们减少压力,放松心情,减轻抑郁情绪。
图2 治疗抑郁症常用药物
基于代谢组学的MDD研究
代谢组是指某一生物或细胞受内源性或外源性干扰后整个生物体系内所有的代谢物。代谢组学是系统生物学的一个分支,是继基因组学、转录组学、蛋白质组学后新发展起来的一门学科,与其他组学不同的是,代谢组学告诉我们生物体系已经发生了什么,能实时动态反映生物体的当前状态。MDD患者脑组织样本不易获取,目前以血液样本为代表的外周组织是MDD患者代谢研究的主要载体,相关研究表明与健康人相比,MDD患者的外周组织代谢出现紊乱。而外周器官代谢的改变可作为MDD治疗的潜在靶点,说明代谢物可能在MDD的控制中枢与外周器官的相互作用中起重要作用。因此,用代谢组学的方法寻找MDD相关的潜在生物标志物不仅有利于揭示其病理机制,还为MDD的早期诊断和预后提供重要的物质基础。随着近二十年来系统生物学的飞速发展,包括液相色谱-质谱(LC-MS)、气相色谱-质谱(GC-MS)和核磁共振(NMR)在内的代谢组学技术已被广泛应用于筛选MDD特征标记代谢物、探究其发病机制和抗抑郁药干预后的血液、尿液和脑脊液样本中的代谢组变化规律。
图3 代谢组学研究常用技术
肠道菌群与MDD之间可能存在关联
肠道是人体最大的微生态系统,在健康状态下,肠道菌群处于微妙的动态平衡状态,一旦受到宿主自身及外界环境变化的影响,宿主与菌群之间的平衡状态就会被打破,导致肠道微生态系统失衡,失衡的肠道菌群会产生不同的代谢物;代谢物可通过影响肠道神经系统影响大脑,出现情绪、认知行为异常,最终导致MDD的发生。
目前已有大量的研究报道已经证实肠道菌群与肠道疾病(如炎症性肠病、肠易激综合征和结直肠癌等)、代谢性疾病(如肥胖、2型糖尿病和非酒精性脂肪肝等)和免疫系统疾病(如风湿性关节炎)的发生发展有着密不可分的关系。另外,肠道菌群也与神经精神疾病相关,其通过“微生物-肠-脑”(MGB)轴实现消化系统和中枢神经系统之间双向动态沟通、互相作用、介导代谢、外周免疫等(Wang et al, 2014)。肠道菌群作为“微生物-肠-脑”轴的重要组成部分,能通过多种方式影响神经系统,如肠道菌群可调节神经递质(谷氨酸、乙酰胆碱、儿茶酚胺、γ-氨基丁酸、血清素、多巴胺、去甲肾上腺素)的合成与功能,这些代谢物会影响大脑中相关神经递质及其前体的浓度,并可能直接或间接影响大脑的神经元活动和认知功能。
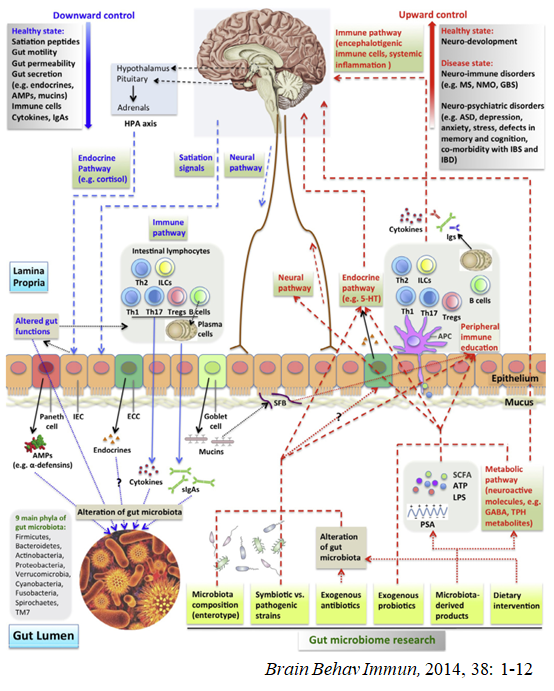
图4 与中枢神经系统疾病相关的微生物-肠-脑轴
MDD患者肠道菌群中菌种的改变
2019年,Valles-Colomer M等人在《Nature microbiology》杂志发表了一项研究。研究表明欧洲MDD患者与正常人相比,其肠道内粪球菌属Coprococcus和小杆菌属Dialister这两种肠道菌群稀少。其中,Coprococcus 似乎有一条与多巴胺(MDD发病过程中关键的脑信号)代谢有关的代谢途径(Valles-Colomer et al, 2019)。2020年,Zahra Amirkhanzadeh Barandouzi等人在杂志《Frontiers in Psychiatry》上的研究表明。MDD患者与健康人群相比,细菌的多样性和丰度存在差异,患者部分菌种的丰度增加(厌氧菌、链球菌、胶菌属、土杆菌属、副杆菌属、埃格特菌属、克雷伯氏菌属等);粪杆菌、双歧杆菌、大肠杆菌/志贺氏菌等菌种丰度减少。值得注意的是,在MDD患者的肠道菌群中丰度发生改变的菌种通常具有碳水化合物代谢能力,如双歧杆菌、粪杆菌和瘤胃球菌等。作者认为由于肠道菌群紊乱导致有益代谢物减少,有害代谢物增加,影响了中枢神经,进而改变神经递质如5-羟色胺的水平,最终影响个体情绪行为,导致MDD发生(Barandouzi et al, 2020)。祖先鹏的博士论文中对114例粪便样本(抑郁症与健康人样本1:1配对)分析结果,发现MDD患者与健康人群的肠道菌群结构存在显著差异,导致其结构失衡的主要特征是一些条件致病菌或潜在致病菌属的丰度显著增加,而对肠道有益的产丁酸盐菌和抗炎性菌属的丰度明显减少。作者推断这些菌群变化可能在MDD发生和发展过程中起到一定的作用。通过对MDD血清和尿液筛选的差异代谢物与测序得到的肠道菌群数据进行相关性分析,其结果发现,MDD患者肠道内产SCFAs(醋酸盐、丙酸盐、丁酸盐和戊酸盐)的细菌菌属与涉及能量代谢、胆汁酸代谢、氨基酸类神经递质代谢的代谢物存在相关性,提示我们肠道菌群结构失调可能影响这些代谢途径,进而影响了宿主的代谢表型(祖先鹏,2018)。
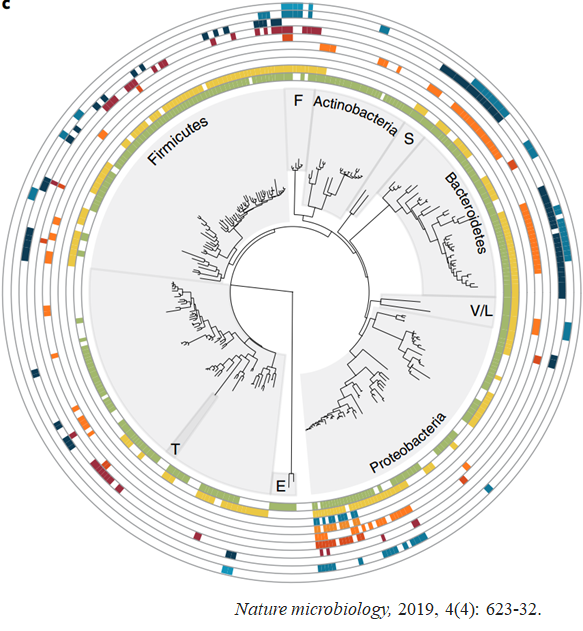
图5 MDD与正常人肠道菌群基因组检测
探究MDD可能存在的代谢途径及潜在生物标志
(1)胆汁酸代谢
胆汁酸(Bile acids, BAs)是胆汁中的主要成分,在肝脏中由胆固醇合成,并由肠道细菌酶进一步加工,因此在其代谢过程中需要人类和肠道微生物组的酶解过程。BAs参与一系列重要的宿主功能,如脂质运输和代谢,细胞信号传导和能量稳态的调节。近期Siamak Mahmoudian Dehkordi等采用代谢组学技术分析了MDD患者的血清中的初级胆汁酸和次级胆汁酸。并评估了BAs浓度与抑郁症患者抑郁严重程度的关系。其结果显示代表肠道微生物组组成变化的BAs图谱与较高的焦虑水平和一线治疗失败的可能性增加有关(MahmoudianDehkordi et al, 2020)。如果得到证实,这些发现表明有可能开发出针对以肠道菌群失调为特征的MDD的肠道微生物组导向疗法;2022年6月,Wu Lirong在杂志《Proteomics》发表的论文中提到胆汁酸在抑郁症、阿尔茨海默病和中风这三种高发脑部疾病中的起到了一定的影响,通过探讨BAs特征及其代谢途径,筛选到与疾病发展相关的潜在标记物生物碱,其机理作用的重点是炎症、“微生物-肠-脑”轴和细胞凋亡(Wu et al, 2022)。
(2)神经递质代谢
2018年,Shan Liang等人发表的研究详细阐述了肠道菌群在MDD发病中的作用,并得出以下结论:由于遗传或外界因素导致的肠道菌群紊乱,在其代谢产物的作用下,导致肠道中5-羟色胺和多巴胺的释放和作用减少,阻碍脑源性神经营养因子(BDNF)的合成,进而导致或加重抑郁症(Shan et al, 2018);Yu Du等人在《Heliyon》发表研究,阐明了肠道菌群紊乱通过单胺类神经递质释放和功效的调节、下丘脑-垂体-肾上腺(HPA)轴活性和功能的改变以及BDNF表达的调节影响MDD的发生,表明“微生物-肠-脑”轴在抑郁症发生中的重要作用(Yu et al, 2020)。
(3)其他代谢
Hilde de Kluiver利用代谢谱分析特征标记代谢物,主要结论如下:MDD患者与健康对照组有7个标志物存在显著差异,分别是乙酰糖蛋白、二十二碳六烯酸、血清总甘油三酯、ω-3脂肪酸、极低密度脂蛋白(VLDL)中的甘油三酯、载脂蛋白B和VLDL胆固醇(P均<0.05)(Kluiver et al, 2020)。
Jun-Xi Pan等的研究中首次全面评估了MDD患者血液中多种神经递质,通过对血浆中多个神经递质系统的代谢物进行靶向评估,确定了血浆中的神经特征标记代谢物:多巴胺、谷氨酸、γ-氨基丁酸(GABA)和血清素(5-HT)等,本研究中的生物标志物组合包括三种代谢途径,血浆神经递质代谢物谱的改变对MDD患者具有潜在的诊断价值(Pan et al, 2018)。
小结
基于血液、尿液及粪便样本,代谢组学技术正在逐步探讨MDD的发病与治疗相关的分子机制,并建立可行的客观诊断及预后预测体系。采用代谢组学技术研究MDD患者的代谢表型并结合肠道菌群多样性结构特征,为揭示MDD的病理生理机制提供了新的视角,对今后诊断和治疗MDD具有重要意义。



