新文速递丨bioRxiv酪胺会促进结直肠癌
结直肠癌(CRC)是全球第三大常见癌症,也是癌症相关死亡的第二大病因。家族性腺瘤性息肉病、饮食和肠道微生物群等因素是促进CRC的危险因素。此外,研究表明大量食用红肉或加工肉类和脂肪,纤维摄入量低可能会增加CRC风险。
酪胺在加工肉类中含量很高,在CRC患者的粪便和粘膜组织中也很丰富。目前仅知晓酪胺会提高血压,少量研究表明酪胺与细胞毒性相关,会改变结肠上皮细胞中DNA损伤和修复相关基因的表达谱。然而,酪胺对肠粘膜健康和CRC的影响尚不明确。
2023年5月,帝国理工学院Jia Li教授团队发表题为“Tyramine promotes colon cancer risk and development by inducing DNA damage and inflammation”的研究成果。该研究假设源自发酵食品的酪胺或肠道细菌对酪氨酸的代谢会增加CRC风险并促进CRC发展。作者使用HCT116细胞系和ApcMin/+小鼠验证这一假设。原文链接:https://doi.org/10.1016/j.jhazmat.2023.130893。
实验设计
细胞实验:用不同浓度的酪胺水溶液(0.2 mM-6.4 mM,pH=7.01)将HCT116细胞(人结肠癌细胞)分别处理24、48、72h,每孔取一定量用于活率、基因毒性、流式细胞计数分析。用0-1000pg/mL的IL-6处理细胞24、48、72h用以评估炎性环境对酪胺治疗的影响。并对其进行细胞凋亡、细胞周期、增殖和DNA损伤分析。
动物实验:将6周龄的ApcMin/+和WT小鼠每天用200µL 3.2 mM、pH=7.01 的无菌酪胺溶液或水(对照)进行口服饲喂,持续 7 周,在小鼠13周龄时结束实验。在整个研究过程中每周监测小鼠的食物消耗量、水摄入量和体重。对小鼠疾病宏观体征的发展进行盲评分,并在第4和7周收集小鼠的尿液和粪便,对收集的样本进行RNA测序和1H NMR等分析。
研究结果
酪胺诱导的细胞死亡和DNA损伤
用0-6.4mM的酪胺处理HCT-116细胞24、48、72h,0.8 mM处理24h酪胺表现出细胞毒性,在浓度高于1.6mM时毒性作用可维持至72h(图1A),低浓度的酪胺未表现出细胞毒性。在酪胺处理后坏死细胞发生的频率以剂量依赖的方式增加;与对照组相比,高浓度酪胺处理后,坏死细胞数量随着凋亡细胞数量的减少而增加,存在剂量依赖性的坏死(图1B)。
已知细胞增殖和DNA不稳定性增加是肿瘤发生的危险因素,因此,作者探究酪胺是否会影响细胞增值和诱导DNA损伤。与对照组相比,用1.2和1.6 mM的酪胺处理24h后,Ki67阳性细胞占比明显升高(图1C),磷酸化组蛋白 H2AX细胞形成γH2AX的频率明显更高(图1D),表明细胞对DNA双链断裂的诱导有反应。此外,作者使用MN试验评估酪胺诱导的 DNA 损伤,用1.2和1.6 mM的酪胺处理诱导了MN(微核)的形成(图1E和1F),表明DNA损伤和染色体畸变的增加。作者在酪胺治疗后6h计数γH2AX 阳性细胞,酪胺未诱导显著的基因毒性效应。

图1. 酪胺降低细胞存活率的主要原因是坏死,并增加微核和双核细胞的数量
作者观察到1.2和1.6 mM 的酪胺诱导细胞周期停滞在G2/M期(图1G),双核细胞的数量增多(图1H)。酪胺处理后,发现G2期γH2AX阳性细胞的数量显著增加,提示DNA修复机制的激活(图1I)。培养基的代谢谱分析显示,酪胺处理的细胞和未处理的细胞分别聚集,表明细胞周期停滞影响细胞新陈代谢和养分利用。此外,作者的研究数据显示,IL-6不会加重酪胺诱导的细胞毒性和基因毒性。
总体而言,作者发现酪胺会导致细胞坏死,促进细胞增殖和DNA损伤,这可能会破坏基因组的稳定性,增加结肠肿瘤发生的风险。
酪胺影响DNA组织和氧化呼吸途径
为了探究酪胺的作用机理,作者将对照组和酪胺处理组(1.2和1.6 mM处理24h)的细胞进行了RNA测序。基因表达谱的PCA图表明这两组细胞间存在显著差异(图2A),两种剂量的酪胺诱导了类似的细胞反应模式,但低剂量组的程度较低。与对照组相比,在1.6 mM和1.2 mM酪胺处理的细胞中,总共有524个和241个差异表达的基因(图2B)。热图展示了对照组和酪胺处理组基因表达的差异,主要是组蛋白基因下调以及参与氧化/还原反应和氧化应激反应的基因上调(图2C)。
对涉及生物过程的基因本体论(GO)的通路分析表明,1.6 mM酪胺处理组染色质组织和组装网络显著减少,对转录调控和基因表达的表观遗传控制产生影响(图2D),这与该剂量下MN出现频率增加的结果一致。涉及NADP/NAD的氧化和还原反应显著减少,表明影响到线粒体的功能(图2E)。IPA 分析一致显示,酪胺处理后出现氧化应激反应和DNA损伤修复增强,同时NAD信号通路下调(图2F)。此外,与结直肠癌转移信号传导和肿瘤微环境相关的过程也得到增强。为了进一步支持酪胺在氧化损伤中的作用,基因集富集分析 (GSEA) 显示活性氧中基因集的过度表达(图2G)。
RNA测序数据分析共同表明,酪胺影响DNA结构并导致氧化应激,这可能是其基因毒性和细胞毒性作用的原因。

图2. 酪胺改变涉及染色质构象、氧化还原反应和CRC信号传导的基因表达谱和通路
酪胺促进 ApcMin/+小鼠肿瘤的发生并增加 WT鼠CRC的风险
基于以上研究结果,作者进一步在ApcMin/+小鼠体内探究酪胺对CRC发展的影响(图3A)。小鼠的体重、食物摄入、饮水在整个研究的各组间无显著性差异(图3B-D)。与野生型对照组相比,无论给药方案如何,ApcMin/+小鼠脾脏重量显著增加,血细胞比容显著降低(图3E-F)。然而,各组间的肝脏重量相当(图3G)。酪胺给药的小鼠,ApcMin/+小鼠的肠道比WT小鼠肠道更短(图3H),表明酪胺和小鼠的遗传菌株之间存在相互作用导致肠道长度的这种表型变化。组织学分析表明,CRC易感小鼠的不典型增生程度相似,与用药无关,酪胺给药不会导致组织学变化(图3I)。
宏观评估表明,接受酪胺给药的ApcMin/+小鼠患肿瘤的数量往往更高,尤其是在结肠中(图4A)。相较于WT型小鼠,ApcMin/+小鼠患肿瘤的数量和比例均更高,但在ApcMin/+小鼠中是否给药酪胺,小鼠患肿瘤的数量没有显著差异(图4B-E)。酪胺对结肠中肿瘤的大小有显著影响,酪胺给药的ApcMin/+小鼠结肠中1-3mm的肿瘤更多(图4F)。
相比于ApcMin/+小鼠的对照组,给药酪胺会有显著影响,导致Ki67+细胞数量增加(图4G),β-连环蛋白的水平在各组中相似(图4H),这些数据表明给药酪胺促进了细胞的增殖,但不影响Wnt/β-连环蛋白信号通路。在ApcMin/+小鼠中,是否给药酪胺的两组小鼠中γH2AX+细胞数没有显著性差异,但WT型小鼠中给药酪胺γH2AX+的细胞数显著高于对照组,说明酪胺可引起体内DNA损伤(图4I-J)。这些数据表明,酪胺促进肠道肿瘤APC模式肿瘤的发生,促进了WT小鼠DNA的损伤。
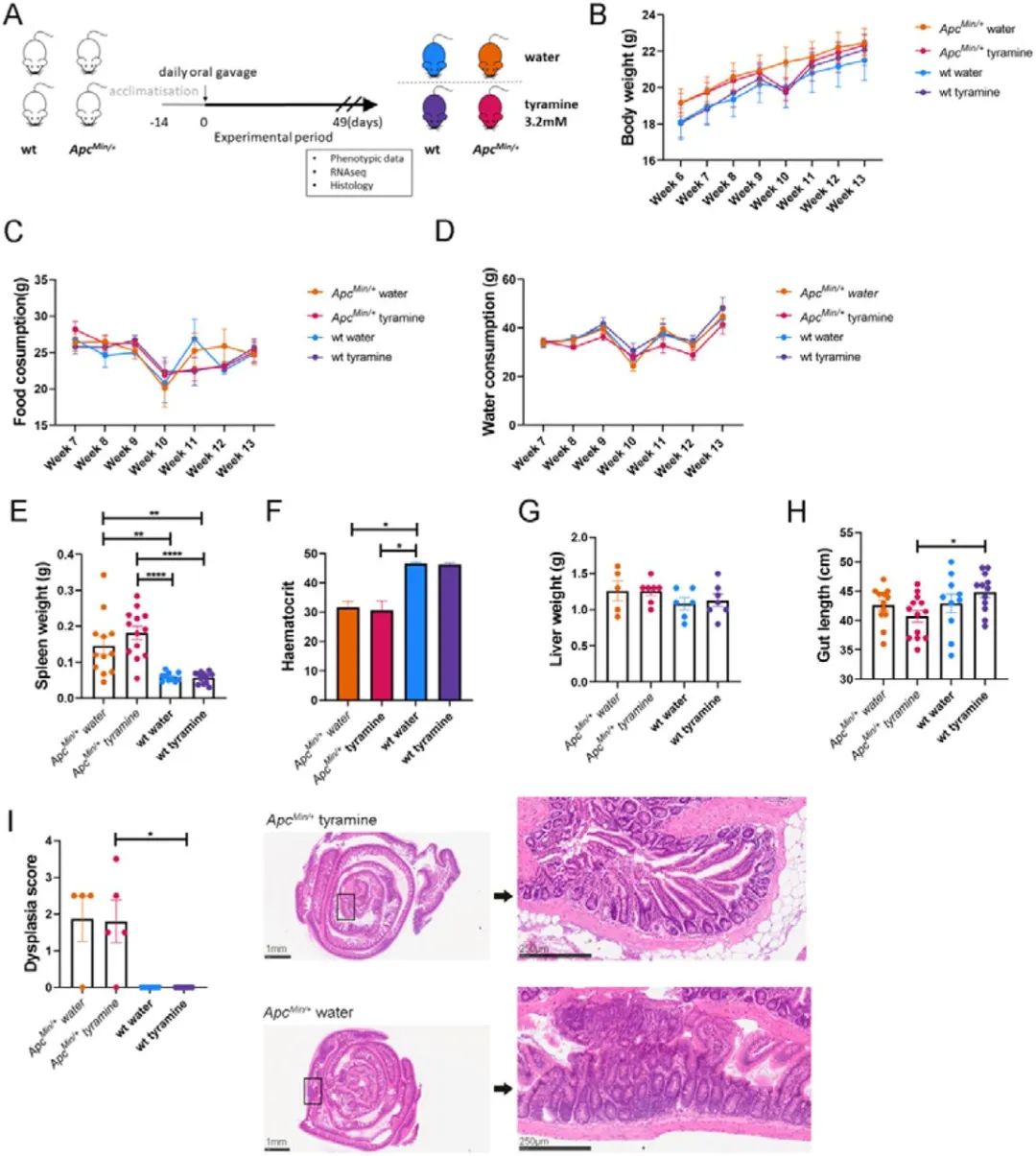
图3. 酪胺给药的 ApcMin/+和WT小鼠的表型特征

图 4. 酪胺促进 ApcMin/+小鼠CRC发展并增加WT对照小鼠CRC风险
酪胺影响ApcMin/+小鼠回肠和结肠中涉及炎症和细胞外基质的基因通路
小鼠口服酪胺后,并未在其尿液或粪样中检测出酪胺,表明均已被肠道吸收。为了更深入了解酪胺在体内肿瘤发生中的功能,作者对ApcMin/+和WT的无肿瘤结肠和回肠组织进行了转录组分析。分析结果显示,酪胺炎症反应相关基因的表达水平上调。在酪胺给药组中,结肠组织IL-17A基因表达上调,回肠组织中性粒细胞颗粒蛋白基因的表达水平上调(图5A-B)。
GSEA通路分析显示,给药酪胺后,结肠组织中参与细胞外基质组织的基因富集,线粒体活性基因表达降低。相反,回肠中细胞外基质组织通路和胶原蛋白生物合成通路下调,表明肠道上皮屏障的变化(图5C-D)。结肠和回肠中观察到的差异归因于它的生理差异及酪胺与肠道内相关受体的结合差异。在给药组,包括细胞外基质糖蛋白和基底膜的通路均下调,表明肿瘤中上皮间质转化和骨髓对周围基质的侵袭。
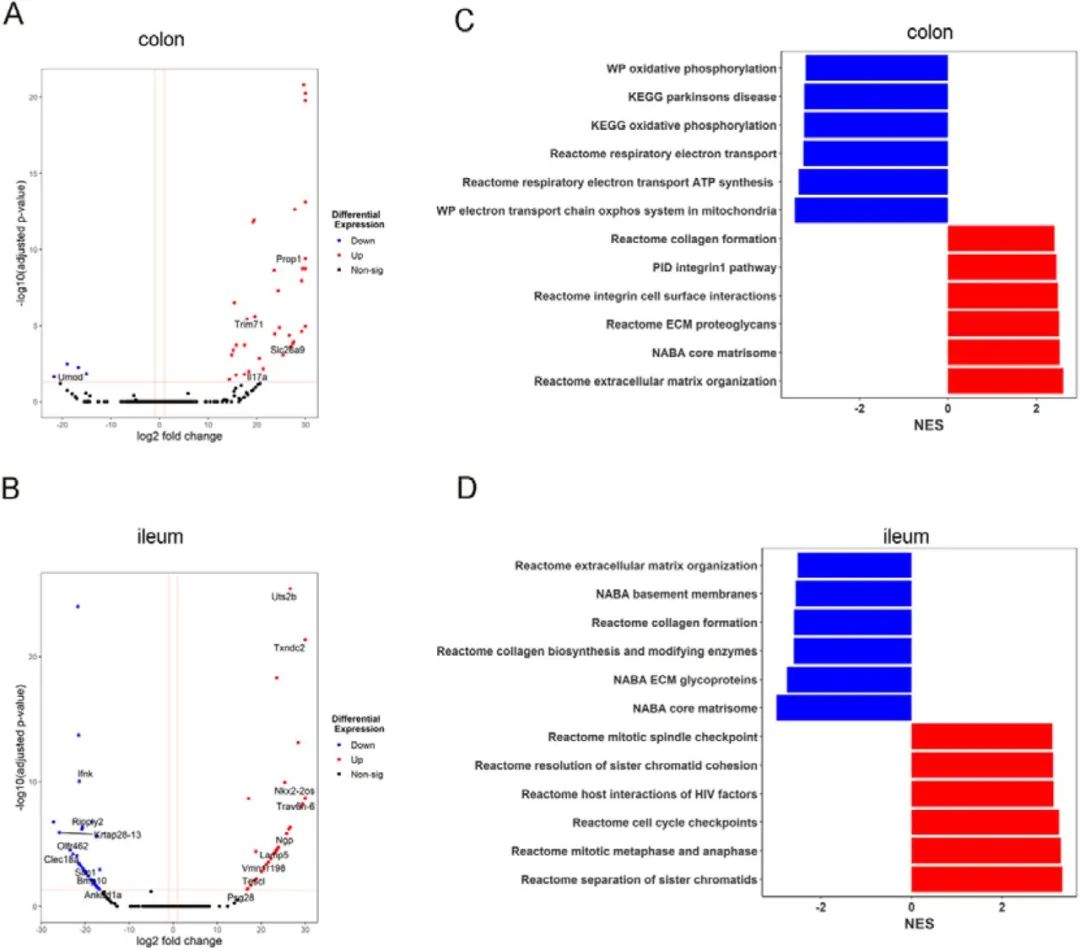
图5. 酪胺促进周围健康肠道组织的炎症环境,从而促进ApcMin/+小鼠中肿瘤的发生
酪胺影响WT小鼠回肠和结肠的细胞周期和上皮屏障功能通路
研究发现,与未处理的小鼠相比,酪胺给药的WT小鼠结肠中细胞分裂周期基因(Cdc34b)的表达显著上调,同时,结肠和回肠中与上皮屏障功能相关的基因包括防御素和C型凝集素(Defb14 和Clec2)的表达水平升高(图6A-B)。
与只经过酪胺给药的 ApcMin/+小鼠相似,与细胞外基质成分相关通路的基因在酪胺给药的WT小鼠结肠中过度表达,然而,从G1期到S期的细胞周期控制减弱,表明细胞增殖控制减少;蛋白质翻译与合成途径的基因在酪胺给药组回肠中的表达上调,表明细胞分裂增加(图6C-D)。与未给药的对照组相比,这些观察结果与酪胺给药的WT小鼠和酪胺处理的HCT116细胞中更高水平的Ki67+细胞一致。总的来说,研究数据表明,酪胺驱动健康肠道组织中的炎症环境,正如ApcMin/+小鼠中IL-17A和Ngp基因的上调所证明的那样,并且在Apc缺陷和野生型环境中与细胞增殖增加和上皮屏障受损有关。
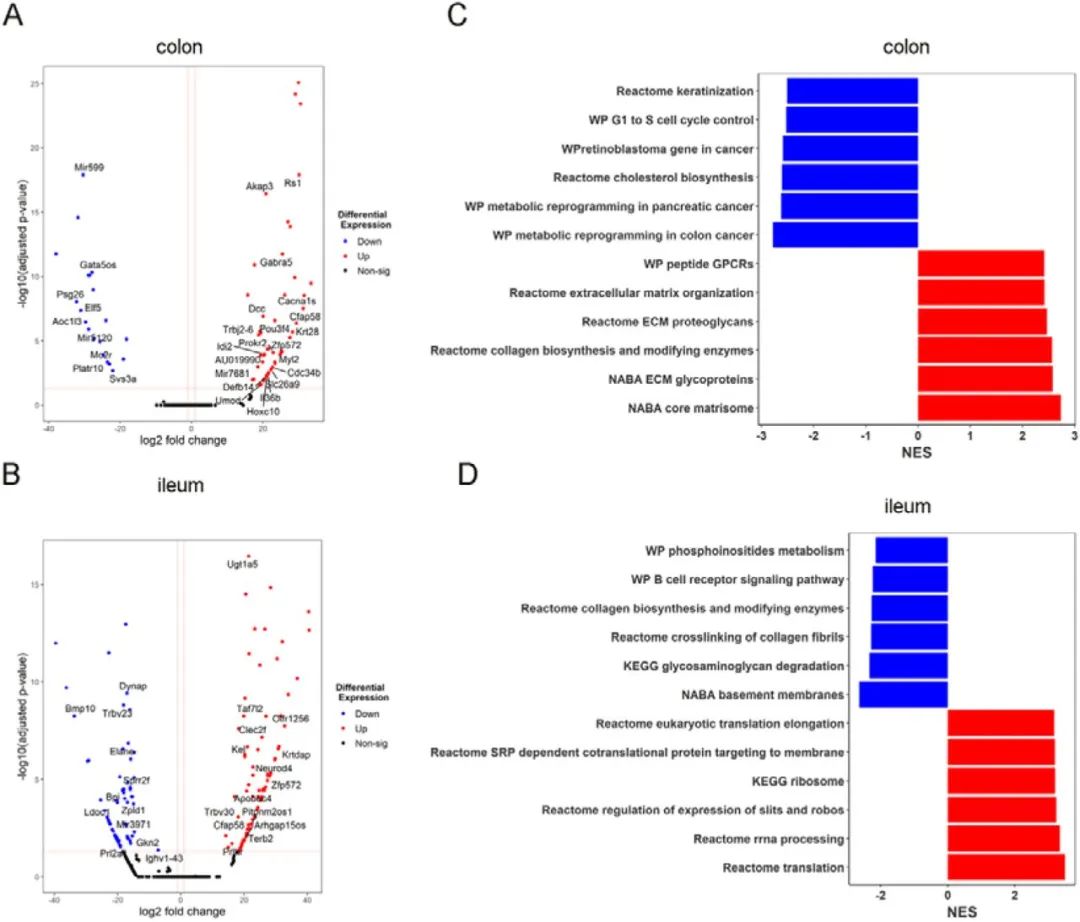
图6. 酪胺改变野生型小鼠上皮屏障功能相关基因的表达谱
酪胺促进肿瘤微环境中的致瘤免疫反应
酪胺已被证明可以增加巨噬细胞中炎症基因的表达,因此,作者使用流式细胞术进一步研究回肠和结肠肿瘤中免疫细胞亚群的功能。作者在结肠肿瘤浸润淋巴细胞(TIL)中的淋巴、先天淋巴和骨髓细胞中观察到相似的频率,但NK细胞和多形核骨髓源性抑制细胞(PMN-MDSC)除外(图7A)。与水处理的 ApcMin/+小鼠相比,酪胺给药的NK细胞频率较低,这伴随着肿瘤微环境NK细胞中NKG2D的平均荧光强度(MFI)的降低(图7B),表明酪胺可能会在肿瘤发生的早期阶段损害有效的抗肿瘤反应。此外,抑制标记物PD-1的MFI在CD8+ T细胞中显示出较高的频率,但未达到统计学显著性(图7C),表明既往细胞毒性CD8+ T细胞活化和潜在耗竭。研究结果表明,酪胺抑制抗肿瘤免疫反应,促进肿瘤发展。
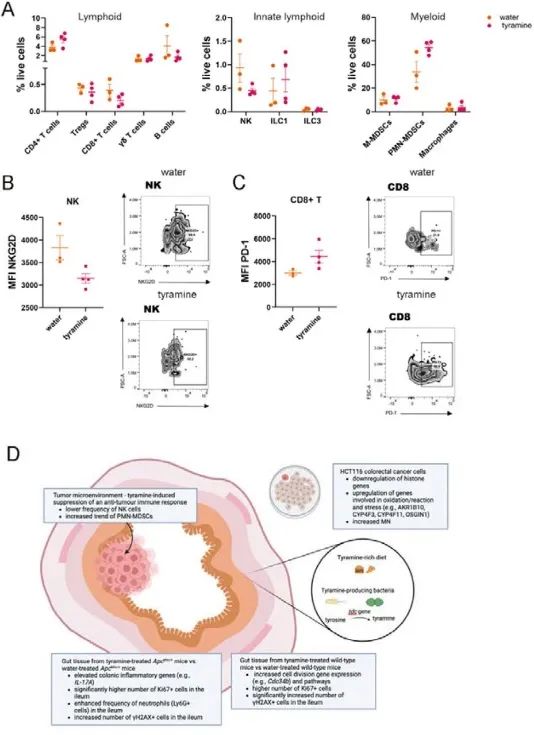
图7. 酪胺抑制结肠肿瘤的抗肿瘤免疫反应
全文总结
作者的研究报道了酪胺对HCT116细胞具有细胞毒性和基因毒性,并诱导细胞周期停滞和细胞坏死。参与染色体组织和氧化应激的基因表达水平在酪胺处理的HCT116细胞中上调。作者在ApcMin/+小鼠的体内实验表明,酪胺显著加剧了肿瘤发生,诱导了促炎反应并增加了细胞增殖(图7D)。最重要的是,在用酪胺给药的小部分WT小鼠中,酪胺诱导了更高水平的DNA损伤,伴随着细胞增殖和肿瘤发生增加的趋势。
延伸阅读:结直肠癌与动物模型
结直肠癌
根据WHO统计结果,癌症是全世界的一个主要死因,2020年近1000万例(或近六分之一)死亡由癌症导致。最常见的癌症是乳腺癌(226万例)、肺癌(221万例)、结肠和直肠癌(193万例)以及前列腺癌(141万例)。
ApcMin/+小鼠
APC(adenomatosis polyposis coli)基因编码的蛋白是一种肿瘤抑制蛋白,充当Wnt信号传导途径的拮抗剂。APC-β-catenin-TCF主导的Wnt通路失调是家族腺瘤息肉病发生的主要途径。APC蛋白表达的缺失或降低可能导致β-catenin免于降解,使游离的β-catenin在胞浆内集聚并进入核内,激活相关靶癌基因,导致细胞癌变的发生。APC蛋白还涉及其他生物调节过程,包括细胞迁移和粘附,转录激活和细胞凋亡。
APC-Min(Min: multiple intestinal neoplasia)突变小鼠特指APC基因第850位氨基酸出现突变的C57BL/6J小鼠。APC基因第850位氨基酸从Leu突变成终止密码子,导致翻译提前终止。APC-Min小鼠品系采用基因编辑技术制作,该品系纯合子不能存活。高脂饮食条件下,雄性和雌性杂合小鼠有明显的肠道腺瘤且数量较多,多见于回肠和空肠。因此,APC-Min小鼠模型是理想的肠道肿瘤模型。
APCMin/+小鼠发病机制是突变的基因产物,截短APC蛋白导致肠道上皮细胞胞质β-catenin蛋白的积累而后使其入核与TCF4/LEF转录因子结合启动下游基因CyclinD 1等原癌基因的活化,但是其腺瘤发生、发展规律和其他生物学特性尚未探索清楚。APCMin/+小鼠与人类家族性腺瘤性息肉病(FAP)表现相似,目前是用于FAP药物开发的理想模型。



