新文速递丨Cell Metab富马酸与肿瘤
肿瘤微环境中的代谢改变显著调节免疫敏感性,但其潜在机制尚不清楚。清华大学江鹏课题组、武汉科技大学祝海川课题组和北京大学张新祥课题组合作,于2023年5月在Cell Metabolism期刊发表了题为“Cancer-cell-derived fumarate suppresses the anti-tumor capacity of CD8+T cells in the tumor microenvironment”的文章,报道了肿瘤细胞富马酸水合酶(fumarate hydratase,FH)缺失导致富马酸在肿瘤间质液中积累,直接使酪氨酸激酶ZAP70在C96和C102处琥珀酸化,并使其浸润CD8+T细胞的活性丧失,从而抑制CD8+T细胞的活化和抗肿瘤免疫反应。这些发现证明了富马酸在控制TCR信号传导中的作用,并表明富马酸在肿瘤微环境中的积累是CD8+T细胞抗肿瘤功能的代谢屏障,富马酸耗尽可能是肿瘤免疫治疗的重要策略。原文链接:https://www.cell.com/cell metabolism/fulltext/S1550-4131(23)00171-7。

Highlights
-
肿瘤特异性FH缺失抑制浸润CD8+T细胞
-
肿瘤细胞产生的富马酸抑制CD8+T细胞活
-
ZAP70被富马酸修饰后抑制CD8+T细胞活化和抗肿瘤功能
-
富马酸耗尽能增强CAR T细胞的抗肿瘤功效
研究背景
癌症的特点是连续的基因变化导致不受控制的生长和扩散。基因组的不稳定性会产生新抗原,这些抗原可以被捕获、加工并呈递给CD8+ T细胞,导致T细胞被激活、识别并靶向癌细胞。ZAP70是一种酪氨酸激酶,在CD8+ T细胞激活的启动中起关键作用。临床上,肿瘤浸润淋巴细胞的存在已被证明与患者预后和生存率的改善有关,然而,除了新抗原呈递缺失或对T细胞产生的细胞因子不敏感等内在因素外,肿瘤还可以通过免疫重编程肿瘤微环境(tumor microenvironment, TME)来抑制T细胞浸润和活化或诱导功能障碍,从而获得逃避免疫识别的能力。因此,深入了解TME中的免疫重编程可能为抗肿瘤免疫提供新思路。事实上,已经开发了许多用于治疗癌症的免疫疗法,包括免疫检查点抑制剂阻断和工程细胞疗法。然而,主要由于微环境抑制,这些免疫疗法往往免疫功能低下,所涉及的分子机制在很大程度上仍然未知。像癌细胞一样,包括T淋巴细胞在内的免疫细胞依赖于TME中的某些营养物质来生存、增殖或激活。例如,活化的T细胞使用糖酵解来提供能量,一些氨基酸包括谷氨酰胺、精氨酸和天冬酰胺以及脂质分子如脂肪酸和甾醇,已被证明对T细胞的有效活化和/或扩增是必不可少的。由于代谢需求和T细胞功能都与TME密切相关,因此T细胞的抗肿瘤功能容易受到TME中营养物质变化的影响。尽管代谢需求和变化对T细胞的影响越来越清楚,但关于代谢操纵如何帮助肿瘤细胞逃避T细胞杀伤的报道仍然很少。
研究结果
肿瘤细胞来源的富马酸抑制TME中CD8+T细胞的激活
肿瘤特异性FH的缺失阻断CD8+ T细胞中的T细胞抗原受体信号(T cell antigen receptor,TCR)激活,抑制了肿瘤浸润性CD8+ T细胞的功能。研究推测FH缺失的肿瘤细胞可能在微环境中积累富马酸从而抑制TME中CD8+ T细胞的激活。作者用[U-13C5]谷氨酰胺处理的FH缺失或正常表达的B16细胞的条件培养基培养CD8+ T细胞,进行了13C代谢流分析(图1E)。与对照细胞相比,来自FH缺失肿瘤细胞的培养基显示13C标记的富马酸增加(图1F),与用FH正常表达的B16培养基培养的T细胞相比,用FH缺失的B16培养基培养的T细胞中,13C标记的富马酸水平明显更高(图1G)。相比之下,来自[U-13C5]谷氨酰胺的其他TCA循环代谢物的水平在这些CD8+ T细胞中几乎保持不变(图1G)。这些结果表明,FH缺失的肿瘤细胞微环境中富马酸确实积累了,进一步提示肿瘤特异性FH缺失可能通过富马酸抑制微环境中的CD8+ T细胞。为了验证这种可能性,作者评估了TCA循环中代谢物对CD8+ T细胞的影响,发现添加富马酸而不是其他TCA循环代谢物,导致CD8+ T细胞中CD69、CD25和CD44的表达减少,富马酸或富马酸酯处理以剂量依赖的方式减弱CD8+ T细胞的活化(图1H)。
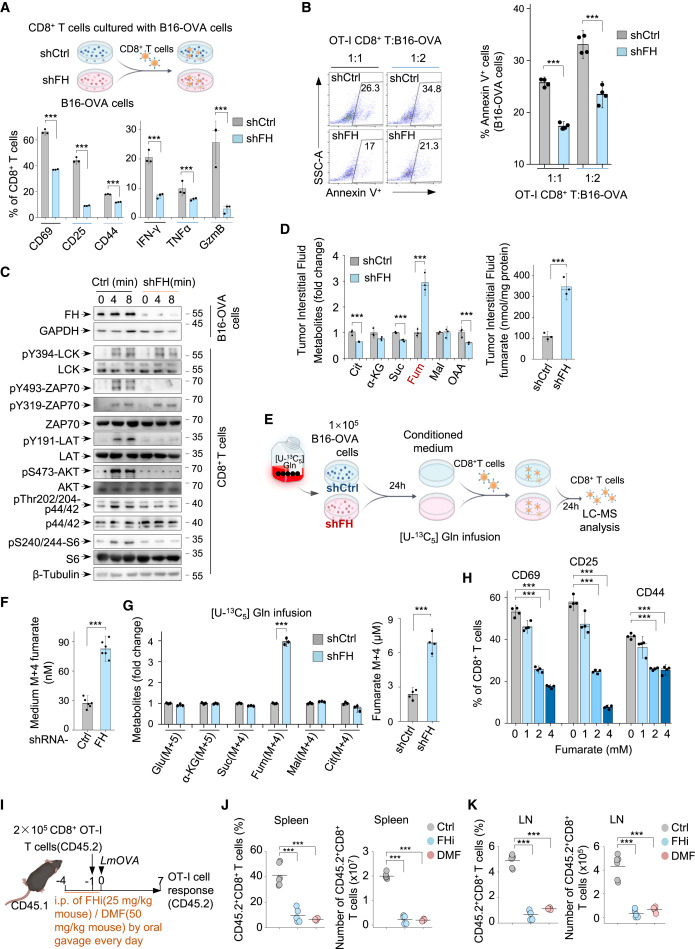
图1. 肿瘤细胞来源的富马酸抑制CD8+T细胞功能
C96和C102是富马酸琥珀化位点,决定了ZAP70的活性
接下来作者研究富马酸抑制T细胞活化的潜在机制。富马酸是一种亲电试剂,可与蛋白质上的亲核半胱氨酸残基反应,通过Michael加成反应生成S-(2-琥珀酰)半胱氨酸(2SC)。富马酸这种独特的反应性意味着它的积累可能会使某些参与信号转导或代谢的蛋白质发生琥珀酸化。TCR信号传导的上游激酶ZAP70显著富集,可能是琥珀酸化的潜在靶点(图2A)。这一发现与肿瘤细胞中FH的缺失阻碍了CD8+ T细胞中Y493处ZAP70及其下游效应物的磷酸化,而不影响其上游激酶LCK的磷酸化的结果是一致的(图1C)。接下来,作者通过2SC印迹、体外激酶测定及点突变验证了富马酸对ZAP70的琥珀酸化作用,表明C96和C102是富马酸的琥珀酸化位点,在调节ZAP70激酶活性中起主导作用。

图2. 确定C96和C102(C96/C102)为决定ZAP70活性的富马酸琥珀酸化位点
富马酸使ZAP70琥珀酸化,调节CD8+ T细胞TCR信号,抑制CD8+ T细胞抗肿瘤功能
ZAP70是TCR信号通路中不可缺少的,它的缺乏导致人类和小鼠严重的联合免疫缺陷。接下来,作者进一步研究了富马酸积累对ZAP70和TCR信号的影响,表明ZAP70是富马酸琥珀酸化的直接靶点,从而将肿瘤细胞中的富马酸代谢与CD8+ T细胞中的TCR信号传导联系起来,富马酸介导的ZAP70琥珀酸化会阻碍CD8+ T细胞中的TCR信号传导。为了评估ZAP70琥珀酸化对TCR信号传导和T细胞功能的调节作用,作者培养了Zap70C96C102S/C96C102S (Zap70CS/CS)转基因小鼠。ZAP70CS/CS对富马酸琥珀酸化具有抗性,但活性降低,表明该突变体可以在功能上减弱富马酸积累的影响,同时减少TCR信号传导和T细胞反应。在Zap70CS/CS小鼠中,ZAP70的C96S/C102S突变可有效阻断TCR信号通路,减少成熟T细胞,从而抑制CD8+ T细胞抗肿瘤能力。细胞和小鼠实验均表明富马酸水平的增加抑制了CD8+ T细胞的活化和抗肿瘤活性。
FH表达的增加增强了CAR T细胞的抗肿瘤作用
CAR T疗法已被广泛证明在B细胞恶性肿瘤中具有很好的抗肿瘤作用,然而,很少有关于CAR T细胞在实体肿瘤中介导持续反应的报道。上述发现FH缺失的肿瘤细胞在微环境中通过积累间质富马酸抑制CD8+ T细胞的激活和抗肿瘤能力,推测T细胞中富马酸消耗的增加可能会增强T细胞的活性。为了证明这一点,作者首先从4例接受CD19靶向CAR T细胞治疗的急性淋巴细胞白血病患者的scRNA-seq数据中分析了FH表达与CAR T细胞功能基因之间的相关性,发现FH的表达水平与CAR T细胞的功能基因表达水平呈强正相关,支持FH确实可能影响CAR T细胞的抗肿瘤活性。体内实验也得到了类似的结果,来自FH缺失的RAJI细胞的肿瘤抑制了CAR T细胞的细胞溶解活性,降低了小鼠的存活率。
此外,作者还研究了CAR T细胞富马酸水平的降低是否会增强CAR T细胞的治疗效果。FH在抗CD19 CAR T细胞中的过表达强烈降低了细胞富马酸水平,TCR信号活性和细胞因子产生相应增加,显著增强了CAR T细胞的体外细胞溶解活性和体内肿瘤杀伤效果。这些数据表明FH是CAR T细胞疗效的关键调节剂,增加FH表达可能是增强CAR T细胞抗肿瘤能力的有力策略。
讨论
肿瘤通过产生抑制性TME来逃避免疫识别和破坏,这种TME排斥T细胞和/或诱导T细胞功能障碍,但TME中的代谢重编程如何促进免疫逃逸仍不清楚。FH突变与肾癌发生密切相关。然而,肿瘤细胞中FH表达或功能失调是否影响TME和肿瘤免疫逃逸尚不明确。这项工作表明肿瘤FH表达的缺失导致间质液富马酸的积累,并抑制浸润性CD8+ T细胞的活化和效应功能。此外,各种体内和体外实验表明,激酶ZAP70是富马酸的天然传感器,并提示ZAP70在感知代谢和微环境变化方面可能具有新的功能并可能为了解ZAP70的生物学功能提供新的视角。
在肿瘤免疫治疗过程中,功能性CD8+ T细胞浸润与较好的预后相关。然而,CAR T疗法和检查点阻断疗法仅对一小部分患者有效。CAR T细胞的大部分免疫功能不全是由TME的抑制引起的。然而,涉及的分子调控机制仍有待进一步研究。本研究发现,富马酸的积累大大降低了CD8+ T细胞和CAR T细胞的抗癌能力,这表明TME中富马酸的积累可能导致CAR T治疗的无反应性。更重要的是,由于富马酸一方面支持肿瘤细胞增殖,另一方面抑制浸润性T细胞的激活,通过增加FH表达消耗富马酸可能是一种非常有吸引力的肿瘤治疗策略。
研究的局限性
FH与肾囊肿和某些类型肾细胞癌的发展有关。然而,关于FH在其他类型癌症中作用的报道非常有限。本研究的部分实验模型使用了肿瘤免疫学研究中广泛使用的小鼠B16黑色素瘤细胞系来阐明富马酸在小鼠肿瘤中的作用。在人类相关性方面,虽然作者根据已发表的单细胞测序数据发现FH表达与几种人类癌症的预后相关,但在黑色素瘤患者中相关数据报道较少,需要更多的临床数据和研究。此外,由于FH在不同组织中的作用可能不同,因此针对FH或富马酸的肿瘤治疗或免疫治疗在临床环境中需要格外谨慎。
延伸阅读:肿瘤微环境与TCA代谢产物
乳酸:宾夕法尼亚大学M. Celeste Simon团队2020年6月在Developmental Cell上发表了题为“Cancer Cells Don’t Live Alone: Metabolic Communication within Tumor Microenvironments”的综述(DOI: 10.1016/j.devcel.2020.06.018),概述了原发和转移性TME中肿瘤细胞和不同间质成分之间代谢通信的最新进展。在非小细胞肺癌中,曾被认为是代谢废物的乳酸比葡萄糖更适合作为TCA循环的底物。在这种情况下,乳酸和葡萄糖是并行利用的,因为乳酸可以通过线粒体LDH活性直接进入TCA循环。通过LDHA的乳酸代谢也可能影响胞质氧化还原状态,并将葡萄糖重定向到戊糖磷酸途径和己糖胺的生物合成。乳酸作为一种信号分子,可能会改变细胞内的信号通路和/或基因表达,从而影响葡萄糖的摄取和分解代谢。肿瘤腔内的癌细胞相互协作,形成代谢“共生”,乳酸穿梭是一个例子,在缺氧区域的癌细胞通过厌氧糖酵解消耗葡萄糖并释放乳酸,然后乳酸被邻近富氧肿瘤区域的癌细胞用作TCA循环的底物。抗血管生成治疗引起的急性缺氧促使胰腺神经内分泌和乳腺癌细胞产生过量乳酸,然后被血管附近的癌细胞利用。类似的代谢“共生”在肺癌和结肠癌中也存在。乳酸穿梭可能是单羧酸转运体(MCTs)差异表达的结果:缺氧的癌细胞表达高水平的MCT4,作为乳酸主要的输出转运蛋白,而富氧区域的癌细胞表达MCT1作为乳酸输入转运蛋白。目前尚不清楚低氧区域肿瘤来源的乳酸在多大程度上对氧化代谢有贡献,因为氧气充足的癌细胞可以很容易地代谢葡萄糖和包括乳酸在内的其他循环营养物质。

丙酮酸和琥珀酸:哈佛医学院的Marcia C. Haigis课题组和Arlene H. Sharpe课题组于2022年8月在Cell Metabolism杂志上发表了题为“Tumor cells dictate anti-tumor immune responses by altering pyruvate utilization and succinate signaling in CD8+ T cells”的文章(DOI: 10.1016/j.cmet.2022.06.008),发现肿瘤来源的乳酸改变了T细胞的代谢,导致CD8+T细胞中丙酮酸羧化酶(PC)活性降低,抑制了T细胞的细胞毒性。乳酸也改变了丙酮酸进入TCA循环的途径,从PC重定向到丙酮酸脱氢酶(PDH)。PDH的抑制增加了PC活性和琥珀酸分泌,从而激活琥珀酸分泌和琥珀酸受体1(SUCNR1),增强T细胞的抗肿瘤细胞作用。

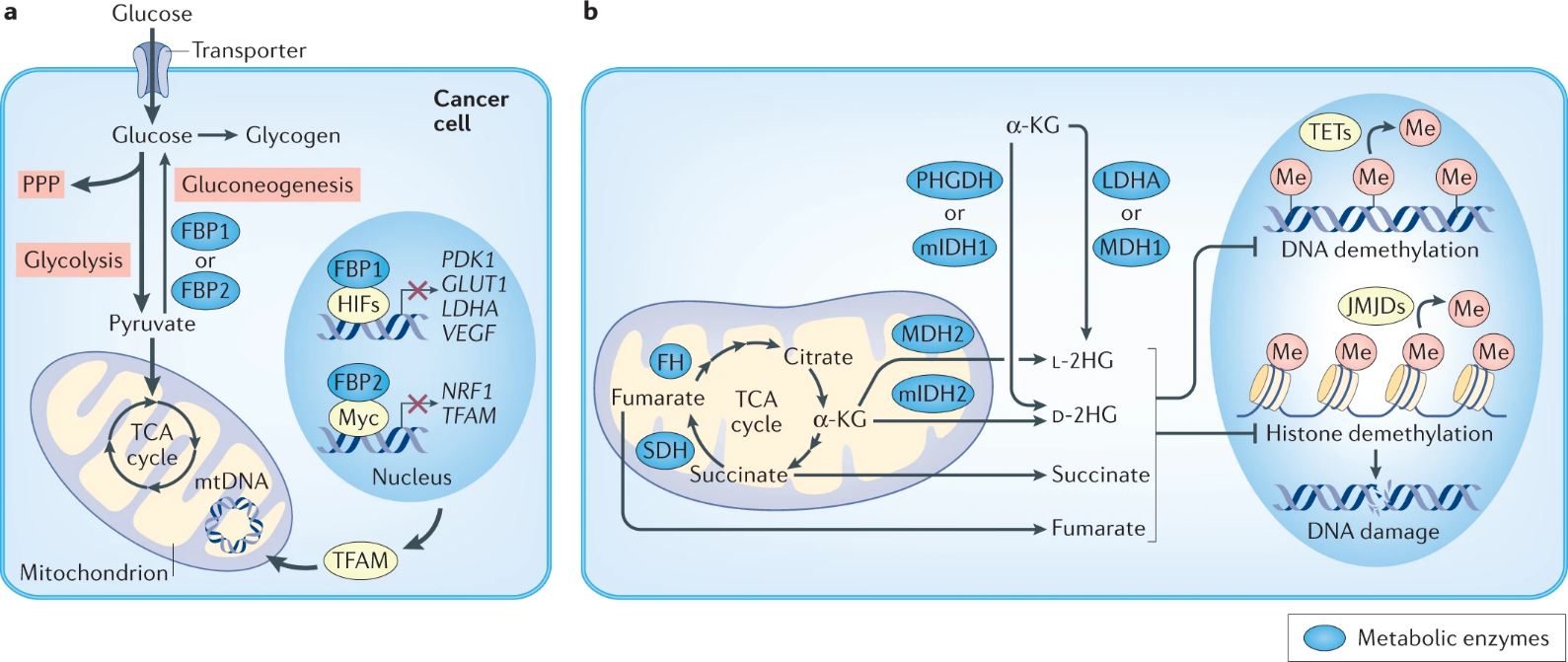
草酰乙酸、琥珀酸、富马酸和2-羟基戊二酸:美国西北大学范伯格医学院Navdeep S. Chandel团队2021年10月于Nature Reviews Cancer上发表了题为“Cancer metabolism: looking forward”的综述(DOI: 10.1038/s41568-021-00378-6),概述了肿瘤代谢领域的最新研究进展。在过去十年,TCA循环再次成为支持肿瘤生长的关键合成代谢中心。丙酮酸羧化酶(PC)催化丙酮酸产生TCA循环代谢物草酰乙酸,已被证明是原发和转移性肿瘤生长所必需的。此外,从草酰乙酸生成的天冬氨酸及其衍生物天冬酰胺都可以限制肿瘤的生长。在特定的肿瘤中,编码琥珀酸脱氢酶(SDH)、富马酸水合酶(FH)以及异柠檬酸脱氢酶1或2(IDH1或IDH2)的基因发生功能缺失突变,会造成肿瘤中代谢产物琥珀酸、富马酸和2-羟基戊二酸(2HG)的浓度增加,这些代谢物是导致不同癌症的诱因,因此被称为“肿瘤代谢物”。这三种肿瘤代谢物中任何一种的积累已被证明有助于恶性肿瘤的发展,但仅限于某些组织。原因是这些代谢物与α-酮戊二酸(α-KG)结构相似从而竞争性抑制α-KG依赖的双加氧酶(α-KGDDs)包括组蛋白去甲基酶、RNA去甲基酶等从而调节表观遗传修饰,影响基因表达。