文献分享丨Nat Rev Cardiol肠道菌群与心衰
近年来,肠道菌群对人类疾病和健康影响越来越受关注。心衰与内脏循环充血有关,导致肠壁水肿和肠道屏障功能受损,这种情况被认为会通过增加全身血液循环中细菌易位和细菌产物来加剧全身炎症状态。肠道微生物通过饮食代谢所产生的代谢物与动脉粥样硬化、高血压、心衰、慢性肾病、肥胖和2型糖尿病等病理相关。这些发现表明肠道菌群像一个内分泌器官一样通过产生生物活性代谢物来直接或者间接影响宿主的生理功能。来自Cleveland Clinic的研究人员2018年在Nature Reviews Cardiology发表综述文章“Dietary metabolism, the gut microbiome, and heart failure”,对最近发现的肠道细菌代谢通路,包括三甲胺、氧化三甲胺、短链脂肪酸和次级胆汁酸的产生进行了讨论。有证据表明这些代谢途径有可能参与心血管疾病包括心衰的发生和发展。另外,作者还讨论了肠道菌群作为一种新的治疗靶点用于心血管疾病治疗,以及潜在的靶向肠道微生物过程的策略。

肠道屏障功能与炎症
健康的肠道微生物群落可以帮助维持肠道屏障功能,包括粘膜紧密连接的完整性和正常的粘膜免疫功能。目前有关心衰的肠漏假说认为心衰时导致的肠壁水肿和屏障功能障碍使肠道菌群成分易位进入宿主循环系统,形成内毒素血症,最后加重全身性炎症。心衰导致的灌注减少对小肠粘膜的绒毛结构影响特别大,因为其对缺血更为敏感,大约一半的心衰失代偿患者会出现粘膜内酸中毒。粘膜壁的胶原蛋白含量也与心衰的严重程度正相关,肠壁增厚与血液循环中的C反应蛋白、白细胞和肠通透性增加直接相关。因此,肠道结构和功能的改变直接导致肠细胞状态恶化,最终破坏了肠道屏障的完整性。
肠道屏障的破坏会使内毒素(也称为脂多糖)进入血液。脂多糖是革兰氏阴性菌的外膜组成成分,是经典的病原体相关模式分子,可以通过模式识别受体Toll样受体4(TLR4)来诱导多种炎症因子的表达。心衰病人的血液内毒素水平会升高。有证据表明肠道吸收内毒素是心衰时产生全身性炎症因子的一种重要刺激因素。心衰患者血液循环中细胞因子(比如TNF、IL-1和IL-6)与临床症状和预后相关。很多临床前证据表明炎症介质参与心脏细胞凋亡、心肌肥厚和纤维化。
血液中高浓度的TNF、IL-1β和IL-6是肠道通透性的诱导剂。肠道通透性增加进一步加重了血液循环中的内毒素效应,形成了一个恶性的前反馈循环路来增加内毒素易位和血液中炎症因子的积累。然而,临床研究表明结果并非如假设的这么简单,很多结果是阴性的,甚至在治疗组心血管事件发生率反而上升。虽然不是心衰的队列研究,但是CANTOS试验中首次发现针对IL-1β的单克隆抗体canakinumab可以抑制炎症通路降低恶性心血管事件的发生率,这一结果与降脂效应无关。除了抗炎,抑制IL-1β受体信号还可以降低上皮细胞紧密连接的通透性,进而通过调控肠道菌群使心血管疾病患者受益。
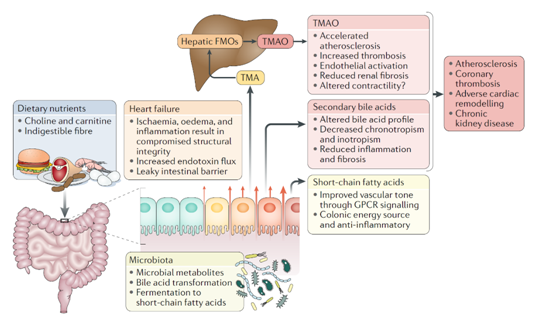
图1连接饮食代谢、肠道菌群和疾病的微生物-宿主途径
关于心衰的肠道假说,目前主要研究都集中在炎症是如何引起心衰和其他相关并发症。大量临床研究发现靶向炎症过程治疗心衰的结果并不一致。这些研究进一步表明应该更加深研究内毒素诱导的炎症和肠道菌群在心衰病理机制中的功能。
心衰中的生态失调
肠道的独特之处在于其持续暴露在数万亿的微生物抗原,这导致肠道屏障的正常功能时刻受到不利影响。肠道菌群也可以直接改变肠道屏障功能。因此,更好地理解肠道菌群将有助于确定对心衰的有益净效应。
肠道菌群的特定群落构成比例在多种疾病中发生变化。动物模型研究表明肠道微生物环境可以影响从食物中获取能量的效率,影响肥胖。现在的研究已经进一步通过肠道菌群移植证明了肠道菌群与疾病易感性传播的内在机制。在心血管疾病方面,包括动脉粥样硬化和血小板激活增加可以通过肠道菌群移植传播,与氧化三甲胺升高有关。此外,一些研究也证明肠道微生物可以将血管张力和血压的变化传给其他人。肠道菌群可以通过产生短链脂肪酸作用于GPCR和FFAR3受体来调节血压。因此,粪便菌群移植有可能用于治疗心血管疾病,已经有研究表明益生菌治疗可以降低大鼠血液中瘦素水平,改善左前冠状动脉降支结扎后的心室功能,但是有关肠道菌群在心衰中的功能研究还非常少。
肠道菌群组成的改变
有小的队列研究已经发现心衰病人的肠道菌群会发生变化。心衰病人的粪便中含有更多的病原性微生物,并且与心衰的严重程度相关。16S rRNA测序是目前鉴定肠道菌群构成比例的标准方法,但是这样的分析仍不能有效鉴定单个菌种。宏基因组和深度测序可以更好的对菌群进行分类。菌群测序发现心衰病人的体内肠道菌群的分类多样性下降,而个体间的多样性可以用来区分心衰患者和对照组。在心衰病人中,研究人员发现肠道微生物编码参与脂多糖合成和促进动脉粥样硬化的代谢物氧化三甲胺产生的基因会富集。老年充血性心衰病人的肠道菌群中产生丁酸的主要细菌普拉梭菌含量下降。这一发现再次凸显了在疾病中肠道微生物通过产生短链脂肪酸调控炎症反应的重要性。虽然肠道菌群在心血管疾病中的作用研究已经迈出了重要的一步,但是心衰病人肠道菌群的多样性研究才刚刚起步,不同研究中鉴定的主要细菌组成存在很多分歧。随着肠道菌群分类方法的标准化,将来的研究必须保证其可重复性。
环境和处理因素
目前研究的一个不足之处就是如何将特定菌群与疾病状态相关联。环境因素,比如饮食,药物和肠道微环境对肠道微生物组都有重要的影响。心衰病人的内在病理生理以及病因的多样性也因引起重视。
肠道菌群和心脏代谢
短链脂肪酸
肠道远端的菌群发酵过程通常会产生短链脂肪酸,短链脂肪酸是结肠上皮细胞的主要营养来源。这些脂肪酸通常含有1-6个碳,是结肠发酵的重要终产物,主要来自膳食纤维、抗性淀粉和上消化道未消化的糖和蛋白质等营养素。结肠中产生的绝大多数短链脂肪酸是乙酸、丙酸和丁酸,比例大概分别为60%、20%和20%。大多数产生的短链脂肪酸被肠道吸收。吸收的短链脂肪酸可以通过与特定的宿主受体结合来影响高血压的发展。
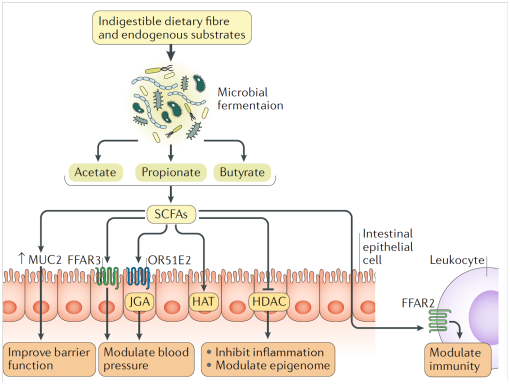
图2肠道菌群产生的短链脂肪酸在心血管系统中的下游效应
产生乙酸的细菌在临床前研究中被认为对治疗高血压、心肌肥厚和纤维化具有潜在的保护作用。由于转录组分析发现短链脂肪酸受体在心肌细胞中表达并不稳定,因此短链脂肪酸如何影响心脏功能仍有待深入研究。此外,短链脂肪酸的药代动力学在人和小鼠之间的差异很大,这也限制了将动物模型的试验结果外推于人类疾病。
胆汁酸
胆汁酸传统上被认为是脂肪和脂溶性维生素的乳化剂,帮助肠道吸收。初级胆汁酸,如胆酸和脱氧胆酸(CDCA)是在肝脏中通过氧化胆固醇合成的。超过95%的初级胆汁酸被重吸收。结肠中肠道菌群可以代谢没被吸收的初级胆汁酸产生次级胆汁酸,比如去氧胆酸(DCA)、石胆酸(LCA)、熊去氧胆酸(UDCA)和大量其他次级胆汁酸。大肠内几乎所有胆汁酸都是次级胆汁酸,浓度约为1000
μmol/l。次级胆汁酸也进入肝肠循环,少量从粪便排出体外。
研究表明胆汁酸的总量及构成比在心衰病人中都会发生改变。心衰病人的初级胆汁酸与次级胆汁酸的比例下降,主要由初级胆汁酸水平下降导致。毫无疑问,胆汁酸和肠道菌群紧密相关,因为肠道菌群可以对初级胆汁酸进行化学修饰,胆汁酸组成的改变可以反过来影响肠道菌群的稳态。我们对胆汁酸生理的认识随着胆汁酸响应受体,如胆汁酸受体(FXR)和各种GPCR的发现而大大提高了。在众多受体中,FXR作为胆汁酸信号受体来调节代谢和炎症被研究的最为深入。CDCA是最强的内源性FXR激活剂,接着是DCA和LCA。FXR也可以通过升高回肠中成纤维细胞生长因子15的水平介导负反馈调控胆汁酸合成。FXR在动脉粥样硬化中的作用已有研究,FXR激活配体可以抑制NFκB起到抗炎作用。由于NFκB信号导致心脏肥大,这些结果为靶向FXR治疗心衰提供了间接证据。然而,相反的结果也有报道,拮抗FXR可以改善心脏功能。由于胆汁酸与心血管疾病相关过程有内在联系,各种研究胆汁酸潜在的临床应用已经开展,但是最终结果仍然是喜忧参半。综合来看,这些结果不仅表明需要额外的验证现有的通路来加速胆汁酸治疗进程,而且提示我们对胆汁酸的理解还十分有限。
三甲胺(TMA)和氧化三甲胺(TMAO)
TMA-TMAO途径是饮食、肠道菌群与动脉粥样硬化和血栓形成危险因素的一个新的交汇点。TMAO由含有TMA基团的食物,如磷脂酰胆碱、胆碱和肉碱等产生。这些营养物质通过多种微生物酶代谢产生TMA,TMA在肝脏中主要由FMO3代谢产生TMAO。
使用非靶向代谢组学作为发现平台,血浆中小分子代谢物水平的增加,包括TMAO,被证明可以预测择期手术的稳定患者心血管疾病风险增加。饮食中直接补充TMAO或者其前体物质均可以导致Apoe-/-小鼠主动脉根部巨噬细胞泡沫细胞形成和动脉粥样硬化斑块发展。血浆中升高的TMAO与心肌梗死、中风的相关性也在队列研究中得到验证。肠道微生物移植研究证实TMAO生成增加、血小板反应性增强和血栓形成都可以有供体传递给受体。
通常讨论的TMAO假设的混杂因素是饮食摄入的鱼类和左旋肉碱。尽管有对这一因素的评论,但是很少有研究直接研究鱼肉、TMAO和心血管疾病之间的关系。并不是所有的鱼肉都含有高浓度的TMAO,一般深海冷水里的鱼类含量较高。对于肾功能正常的人来说,吃鱼只会导致一过性尿液中TMAO升高。一项研究表明,与大豆或者酪蛋白饲料相比,在西方饮食中添加鱼蛋白使Apoe-/-小鼠动脉粥样硬化增加。需要引起注意的是,鱼肉中的鱼油有可能抵消TMAO的有害效应。

图3肠道菌群分解进食产生的TMA和TMAO
左旋肉碱是一种常用的食品添加剂,其可以改善血脂代谢。一项研究表明左旋肉碱可以导致TMAO水平升高,但是却可以降低动脉粥样硬化负担。但是这项研究使用的是雄性小鼠,雄性小鼠的Fmo3本底表达水平非常低,要比雌性低100倍,升高的TMAO如果换算成绝对浓度,仍然是非常低的,不足以导致任何疾病。总的来说,在微生物代谢物的讨论中,TMAO很可能只是冰山一角。非靶向代谢组分析已经发现很多其他未知代谢物与恶性心血管事件相关,因此大概率还存在与心衰和心脏代谢疾病相关的其他的微生物代谢物。
TMA-TMAO途径
自从第一个研究证明TMA-TMAO微生物-人代谢途径可以产生疾病相关代谢物促进动脉粥样硬化形成,很多病理生理效应都与TMAO相关。血浆TMAO水平与血栓形成事件相关,因为TMAO可以通过刺激钙依赖性信号增强血小板反应性。尽管有大量的临床和动物模型数据支撑TMAO与心血管疾病之间的联系,但是仍然还有很多问题没有解决。比如是否存在TMAO受体蛋白。TMAO可以作为改变蛋白质构象的小分子伴侣来发挥功能,因此,TMAO可能通过变构修饰而不是经典的配体-受体相互作用来影响信号通路。
动物实验表明,给小鼠喂食胆碱或者TMAO导致全身TMAO水平升高,心肌纤维化加重,血流动力学恶化。此外,去除饮食中的TMAO可以改善小鼠经主动脉缩窄后的心肌恢复。抑制TMA和TMAO的产生可以显著改善不利的心室重塑和血流动力学参数。
除了动物模型,在心衰病人中也同样发现TMAO水平升高,并且患者血浆TMAO水平与慢性心衰患者的长期生存率降低相关。因此,了解TMAO水平为什么在心衰病人中升高可能为深入了解肠道菌群对心衰进展的影响提供有价值的信息。多项研究表明在慢性情况下,TMAO通过增加心肌纤维化和舒张功能不全影响心衰易感性和事件发生的风险。

图4 慢性心衰患者血浆中TMAO水平与5年死亡风险之间的关系
约40-50%的心衰病人有不同程度的肾功能障碍。因此,适当的心衰管理也需要密切关注任何潜在的肾功能障碍。肾功能和TMAO水平的强相关性已经在多项大鼠研究中得到确认,超过95%的TMAO由肾脏排出。慢性肾病CKD患者TMAO水平升高与死亡风险增加显著相关。小鼠研究也表明FMO3表达升高与肾功能降低成正相关。
心衰的肠道菌群干预
益生元和益生菌疗法
益生元是不可消化的食物,其可以改变肠道微生物的组成和功能,诱导特定微生物的生长。而益生菌是活的微生物。补充益生元和益生菌可以改善肠道菌群平衡。一些初步证据表明服用特定的益生菌可以保护心脏。瘦素减少被认为是益生菌有益效应的潜在机制。然而,16S rRNA测序在GR-1研究中表明,益生菌干预似乎并没有定值成功,也没有改变肠道菌群的结构。有意思的是,一项随机对照试验表明博拉酵母干预对心衰病人在一定程度上有益,但是这些发现都是非常初步的。虽然益生菌有极好的安全记录,但是缺乏对其调控可能会提高引起潜在的益生菌易位进入血液和相关脓毒症的风险。
饮食干预
饮食干预可以改变心衰的进展,主要集中在低盐饮食预防高血压和维持体内稳态。美国心脏病协会指南推荐的高血压病人食谱(DASH饮食)富含水果、蔬菜、全谷物和低脂制品,包括肉、鱼、家禽、坚果和豆类。要减少含糖食物和饮料,红肉和脂肪的摄入。有研究表明上述饮食可以降低心衰的发病率。除了DASH饮食,有关额外的饮食干预作为最终治疗心衰的方案还未有报道。适当的营养,如地中海饮食,当然可以帮助预防心血管疾病以及随后发生的心衰。
微生物TMA裂解酶抑制剂
血浆TMAO水平升高与心衰有很强的相关性,靶向TMAO生成有可能是潜在的肠道菌群干预靶点。不同的微生物酶系统参与TMAO前体物质TMA的形成。胆碱利用基因簇编码催化和调节多肽,胆碱TMA裂解酶(CutC)和胆碱TMA裂解酶激活酶(CutD)似乎是人体肠道菌群将胆碱转化成TMA的主要微生物分解酶系统。其他对TMA生成有贡献的微生物酶系统是肉碱单加氧酶(CntA/CntB和YeaW/YeaX),其可以将肉碱转化为TMA。
DMB作为一种CutC竞争性抑制剂来降低TMAO的生成。这种抑制剂被发现对含有CutC的人类肠道菌群不是致命的,但是可以抑制TMA的生成,并且降低实验小鼠血液中TMAO水平。更重要的是,DMB可以降低Apoe-/-小鼠的动脉粥样硬化进展,没有明显的毒性。

图5 作为潜在药物靶点的肠道菌群代谢途径
未来研究方向
认识到肠道菌群对健康和疾病易感性的影响为我们研究疾病和治疗方法提供了新的视角。未来的研究方向包括研究肠道菌群影响心衰和心血管疾病的分子机制,微生物之间以及微生物和宿主之间是如何相互作用的。要理解宿主受体是如何传递信号并导致宿主生理变化仍然还有很长的路要走。此外,需要对可能影响个人对疾病易感性的特定遗传因素进行研究,来探索其和营养与肠道菌群功能的关系。最后,以微生物为中心的转化研究很有必要是精心设计的、前瞻性的和纵向的研究。
虽然肠道微生物基因组测序在研究中变得越来越普遍,但是这种方法如何应用于临床还不清楚。除了昂贵的元基因组分析,测序信息不能用于估计微生物组的表型模式,只是基于存在基因的推测得到可能发生的表型。相反,测量血液和尿液的代谢轮廓来指导适当的饮食建议,提供有针对性的干预将会使发现的结果更具有转化潜力。
未来干预可以有多种形式。除了饮食干预,螯合剂或者结合树脂抑制微生物代谢物的吸收也是一种可行的方法。胆汁酸螯合剂是第一批降脂药,所以类似方法对于肠腔内的代谢物已有先例。另一个可能的方法是非致死性微生物抑制剂,如TMAO生成抑制剂DMB。其他更有效的TMA裂解酶抑制剂正在研发之中,并且使用这种抑制剂理论上不会导致细菌耐药性。最后,利用益生元或益生菌进行干预肠道菌群的结构和功能来实现微生物代谢物变化是另一种选择。
结论
毫无疑问,肠道菌群和心血管系统存在复杂的关系,这种关系可以影响甚至决定心血管疾病。其他疾病、抗生素、饮食和益生菌可以彻底改变肠道菌群的组成,从而影响我们的健康。未来的研究必须阐明这些复杂关联背后的机制来确定肠道菌群与心衰之间是否存在因果关系。因为肠道菌群是一个全新药理靶点,我们需要对背后的机制有一个全面的认识从而为心衰的靶向治疗铺平道路。



