干货分享丨脂蛋白亚类介绍
脂蛋白定义
血脂主要指血液中的甘油三酯和胆固醇,这两种物质都是“油性”的,不能溶解于水,所以无法在血液中独立存在和转运,需要有专门的“车辆”拉着它们去想去的地方,这些车辆就叫做“脂蛋白”。
而“车辆”上的蛋白质部分就叫“载脂蛋白”,其中最常见到的就是“载脂蛋白A”与“载脂蛋白B”。载脂蛋白A负责把胆固醇从动脉粥样斑块中的胆固醇拉出来运回肝脏处理利用,载脂蛋白B专门把血液中的胆固醇送往动脉壁内、促进粥样斑块形成。
脂蛋白(Lipoprotein)的科学定义是指血液中运送水不溶性脂类的超分子组装体(球状微粒),由富含胆固醇酯、甘油三酯的疏水性内核和由载脂蛋白、单层磷脂、胆固醇等组成的外壳构成。
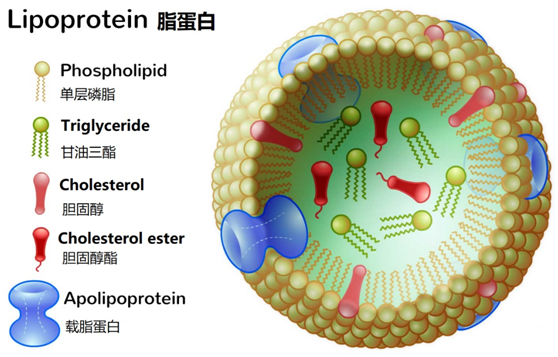
外壳:载脂蛋白、单层磷脂和胆固醇
载脂蛋白主要有A、B、C、D、E五类,还包括H、L和(a)等,各类载脂蛋白又可细分几个亚类,以罗马数字表示,基本功能是运载脂类物质及稳定脂蛋白的结构,某些载脂蛋白还有激活脂蛋白代谢酶、识别受体等功能,主要在肝(部分在小肠)合成。如载脂蛋白A可分为AⅠ、AⅡ、AⅢ,载脂蛋白B可分为B100和B48等。载脂蛋白的主要生理功能是维持脂蛋白的结构和密度,转运脂质,参与各种酶活性的调节,识别受体结合。
单层磷脂主要作用是构成生物膜,亲水端朝外,疏水端朝内,形成一个疏水性内核。
在外壳上的胆固醇也称游离胆固醇,未与脂肪酸酯化。
内核:胆固醇酯和甘油三酯
胆固醇与脂肪酸的酯化增加了疏水性,使胆固醇酯成为胆固醇运输最合适的形式,是脂蛋白中胆固醇的主要形式。
甘油三酯由于其疏水性,只能位于内核运输。
脂蛋白的分类
不同脂蛋白中蛋白质脂类成分所占比例不同,因而分子密度不同(甘油三酯含量多者密度低,蛋白质含量多的分子密度高),在一定离心力作用下,分子沉降速度或漂浮率不同,将脂蛋白分为四类,即乳糜微粒(Chylomicrons,
CM)、极低密度脂蛋白(Very Low Density Lipoprotein, VLDL)、中密度脂蛋白(Intermediate Density Lipoprotein, IDL)、低密度脂蛋白(Low Density Lipoprotein, LDL)和高密度脂蛋白(High
Density Lipoprotein, HDL)。
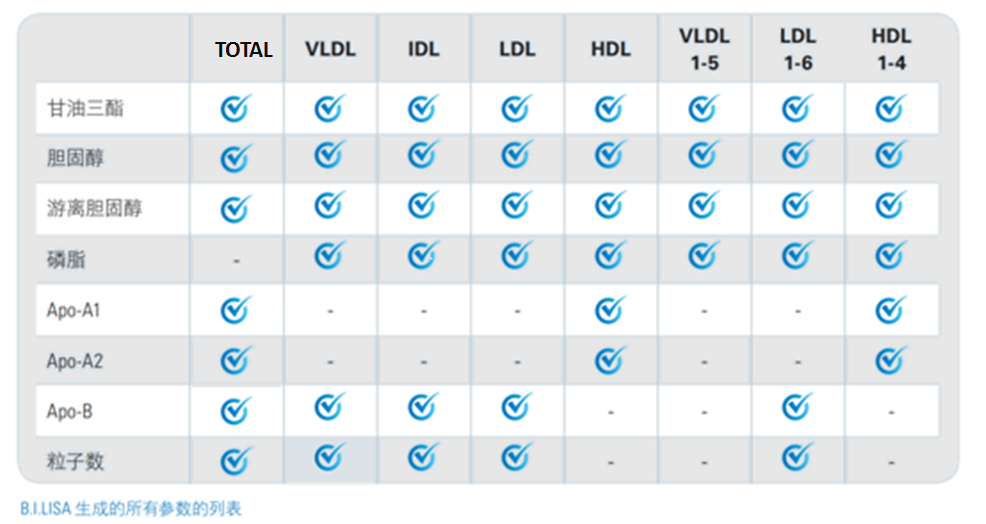
如果进一步细分,VLDL可分为5个亚类(VLDL 1-5),LDL可分为6个亚类(LDL 1-6),HDL可分为4个亚类(HDL 1-4),各亚类的表达与功能不尽一致。
脂蛋白的代谢过程
乳糜微粒(CM)
乳糜微粒是在小肠粘膜细胞中生成的,食物中的脂类在细胞滑面内质网上经再酯化后与粗面内质网上合成的载脂蛋白构成新生的乳糜微粒(包括甘油三酯、胆固醇酯和磷脂以及ApoB48),经高尔基复合体分泌到细胞外,进入淋巴循环最终进入血液。
新生乳糜微粒入血后,接受来自HDL的ApoC和ApoE,同时失去部分ApoA,被修饰成为成熟的乳糜微粒。成熟分子上的ApoCⅡ可激活脂蛋白脂肪酶(LPL)催化乳糜微粒中甘油三酯水解为甘油和脂肪。该酶存在于脂肪组织、心和肌肉组织的毛细血管内皮细胞外表面上。脂肪酸可被上述组织摄取而利用,甘油可进入肝脏用于糖异生。通过LPL的作用,乳糜微粒中的甘油三酯大部分被水解利用,同时ApoA、ApoC、胆固醇和磷脂转移到HDL上,CM逐渐变小,成为以含胆固醇酯为主的乳糜微粒残余颗粒。肝细胞膜上的ApoE受体可识别CM残余颗粒,将其吞噬入肝细胞,与细胞溶酶体融合,载脂蛋白被水解为氨基酸,胆固醇酯分解为胆固醇和脂肪酸,进而可被肝脏利用或分解,完成最终代谢。
由此可见,CM代谢的主要功能就是将外源性甘油三酯转运至脂肪、心和肌肉等肝外组织而利用,同时将食物中外源性胆固醇转运至肝脏。
极低密度脂蛋白(VLDL)和中密度脂蛋白(IDL)
VLDL主要在肝脏内生成,VLDL主要成分是肝细胞利用糖和脂肪酸(来自脂动员或乳糜微粒残余颗粒)自身合成的甘油三酯,与肝细胞合成的载脂蛋白ApoB100、ApoA-I和ApoE等加上少量磷脂和胆固醇及其酯。小肠粘膜细胞也能生成少量VLDL。
VLDL分泌入血后,也接受来自HDL的ApoC和ApoE:ApoC-Ⅱ激活LPL,催化甘油三酯水解,产物被肝外组织利用。同时VLDL与HDL之间进行物质交换,一方面是将ApoC和ApoE等在两者之间转移,另一方面是在胆固醇酯转移蛋白(cholesteryl
ester transfer protein)协助下,将VLDL的磷脂、胆固醇等转移至HDL,将HDL的胆固醇酯转至VLDL,这样VLDL转变为中间密度脂蛋白(IDL)。IDL有两条去路:一是可通过肝细胞膜上的ApoE受体而被吞噬利用,另外还可进一步入被水解生成LDL。
由此可见,VLDL是体内转运内源性甘油三酯的主要方式。
低密度脂蛋白(LDL)
LDL由VLDL转变而来,LDL中主要脂类是胆固醇及其酯,载脂蛋白为ApoB100。
LDL在血中可被肝及肝外组织细胞表面存在的ApoB100受体识别,通过此受体介导,吞入细胞内,与溶酶体融合,胆固醇酯水解为胆固醇及脂肪酸。这种胆固醇除可参与细胞生物膜的生成之外,还对细胞内胆固醇的代谢具有重要的调节作用:①通过抑制HMG-CoA还原酶(HMG-CoA
reductase)活性,减少细胞内胆固醇的合成;②激活脂酰CoA胆固醇酯酰转移酶(Acyl CoA: cholesterol acyltransferase,ACAT)使胆固醇生成胆固醇酯而贮存;③抑制LDL受体蛋白基因的转录,减少LDL受体蛋白的合成,降低细胞对LDL的摄取。
除上述有受体介导的LDL代谢途径外,体内内皮网状系统的吞噬细胞也可摄取LDL(多为经过化学修饰的LDL),此途径生成的胆固醇不具有上述调节作用。因此过量的摄取LDL可导致吞噬细胞空泡化。
从以上可以看出,LDL代谢的功能是将肝脏合成的内源性胆固醇运到肝外组织,保证组织细胞对胆固醇的需求。
高密度脂蛋白(HDL)
HDL在肝脏和小肠中生成。HDL中的载脂蛋白含量很多,包括ApoA、ApoC、ApoD和ApoE等,脂类以磷脂为主。
HDL分泌入血后,新生的HDL为HDL3,一方面可作为载脂蛋白供体将ApoC和ApoE等转移到新生的CM和VLDL上,同时在CM和VLDL代谢过程中再将载脂蛋白运回到HDL上,不断与CM和VLDL进行载脂蛋白的变换。另一方面HDL可摄取血中肝外细胞释放的游离胆固醇,经卵磷脂胆固醇酯酰转移酶(LCAT)催化,生成胆固醇酯。此酶在肝脏中合成,分泌入血后发挥活性,可被HDL中ApoAI激活,生成的胆固醇酯一部分可转移到VLDL。通过上述过程,HDL密度降低转变为HDL2。HDL2最终被肝脏摄取而降解。
由此可见,HDL的主要功能是将肝外细胞释放的胆固醇转运到肝脏,这样可以防止胆固醇在血中聚积,防止动脉粥样硬化,血中HDL2的浓度与冠状动脉粥样硬化呈负相关。
血脂临检指标
现在血脂化验一般有两个套餐,一个是“血脂四项”,就是总胆固醇(Cholesterols,TC)、甘油三酯(Triglycerides, TG)、高密度脂蛋白胆固醇(HDL-C)、低密度脂蛋白胆固醇(LDL-C)这四项;另一个是“血脂全套”,除了前面的四项还有脂蛋白(a)、载脂蛋白A1(ApoA1)和载脂蛋白B(ApoB)这三项。
TC是指血液中各种脂蛋白所含胆固醇的总和,当TC单独升高,可以诊断为高胆固醇血症,临床首选他汀类药物治疗。TC水平对ASCVD发病危险有预测作用。
TG升高是心血管剩留风险的重要组分。
HDL-C是血液中密度最高、颗粒最小的的脂蛋白,高密度脂蛋白负责把斑块内的胆固醇运输至肝脏进行分解代谢,即胆固醇逆转运,减少胆固醇在血管壁的沉积,起到抗动脉硬化作用。
LDL-C增高是动脉粥样硬化发生、发展的主要危险因素,LDL - C负责把胆固醇由肝脏运输到斑块内,增加了ASCVD发病风险。
Lp(a)富含胆固醇,可促进动脉粥样硬化,还能促进血管炎症,当Lp(a)和LDL-C同时升高,表明患ASCVD风险增高。
Apo A1可以反应HDL水平,与HDL-C水平呈正相关,它对心血管有保护作用。
ApoB主要分布在LDL中,可代表LDL水平,与LDL-C呈正相关,可促进ASCVD的发生。
血脂指标与脂蛋白亚类
临床检测的原理基于酶促反应,仅需2分钟。但是这样得到的结果并不精准,总胆固醇和HDL是检测得到的,剩下的指标如甘油三酯等都是通过计算得到的。此外,临床上总胆固醇是不同种类脂蛋白上胆固醇的总量,也不区分游离胆固醇和胆固醇酯,其它指标也存在类似问题。有研究发现,在心血管风险评中,特定脂蛋白亚类的胆固醇和甘油三酯的浓度比它们在血浆中的总浓度更有用,美国心脏病学院/美国心脏病协会(ACC / AHA)在2013年发表的指南不再设定降胆固醇治疗的目标值。
举例临床上的HDL-C,脂蛋白亚类除了能直接测得外,还会分别检测HDL1-C~ HDL4-C(4种HDL脂蛋白亚类中的胆固醇),甚至检测HDL1-FC~ HDL4-FC(4种HDL脂蛋白亚类中的游离胆固醇)。
Bruker于2018年开发的标准化方法,可从临床血清、血浆中检测到112种脂蛋白亚类,整个实验和分析流程可全自动完成,单个样本仅需10分钟。