新文速递丨CellRepMed孕酮与前列腺癌
前言
前列腺癌的发展依赖于雄激素,雄激素剥夺疗法(ADT)和阿比特龙联合使用可降低患者雄激素水平。然而前列腺癌细胞可能利用其他肿瘤代谢物来促进增殖。
越来越多的证据表明前列腺癌中存在其他肿瘤代谢物,类固醇与雄激素具有共同的环戊菲蒽四环结构,可能有致癌作用,依赖或独立于雄激素受体(AR)。然而,雄激素的强大功能掩盖这些作用,接受ADT和阿比特龙联合治疗的患者可以提供一个独特的模式来发现新的肿瘤代谢物。
2022年3月,复旦大学唐惠儒教授、同济大学吴登龙教授及中国科学院上海生物化学与细胞生物学研究所李振斐研究员课题组共同在《Cell Reports Medicine》期刊发表了题为“Inhibiting 3βHSD1 to eliminate the oncogenic effects of progesterone in prostate cancer”的研究成果。在这项研究中,作者对接受ADT和阿比特龙治疗患者的血浆样本进行了基于UHPLC-MS的代谢物筛选。作者发现孕酮在前列腺癌中作为一种致癌激素,激活典型和非典型雄激素受体(AR)靶基因,通过GATA2转录因子促进细胞增殖。3β-羟基甾体脱氢酶1(3βHSD1)的抑制剂BCA可以抑制孕酮的生成,消除其致癌作用。血浆孕酮水平与临床治疗结果相关,孕酮有可能作为阿比特龙治疗反应的预测生物标志物。下面由深耕代谢组学的青年学者刘平辉,为我们带来这篇文章的全方位解读。原文链接:https://doi.org/10.1016/j.xcrm.2022.100561。
研究结果
筛选潜在肿瘤代谢物
为确定导致疾病进展新的肿瘤代谢物,收集了10名患者在阿比特龙治疗前后的血浆样本,并通过UHPLC-MS进行分析。在6625个代谢物中,孕酮增加最多,雄烯二酮(AD)下降最显著(图1A)。上海同济医院73例患者的临床数据也表明,在阿比特龙治疗后孕酮增加最显著(Figures 1B, 1C)。为了排除ADT的潜在干扰,仅在去势抵抗性前列腺癌(CRPC)患者中进一步分析血浆孕酮水平与治疗反应之间的相关性。终点血浆孕酮浓度较高的CRPC患者表现出较弱的前列腺特异性抗原(PSA)减少和较早的疾病进展(图1D, 1E)。研究表明孕酮在前列腺癌中是一种潜在的致癌激素。
孕酮调节的典型AR信号转导
为了探讨孕酮的致癌作用,用不同的前列腺癌细胞株分别用孕酮处理后进行细胞增殖实验。孕酮促进AR阳性细胞系(LNCaP和VCaP)生长,但不促进AR阴性细胞系(PC3和DU145)生长,VCaP细胞的转录组分析证实孕酮处理后AR信号被激活(图1F, 1G)。孕酮诱导的LNCaP和VCaP细胞的增殖依赖于雄激素受体(AR),而不是孕酮受体(PR)。由于LAPC4细胞中AR的含量有限,孕酮对LAPC4细胞的增殖没有影响,孕酮仅在加入多西环素(Dox)时激活LAPC4细胞AR信号表达(图1F-1I)。证明孕酮通过AR发挥其致癌作用。
竞争分析表明孕酮对ART878A和ARH875Y有高亲和力,但对ARW742L和ARM750T亲和力低(图1J)。孕酮可显著激活ART878A和ARH875Y同时促进细胞增殖,但不能激活ARW742L和ARM750T,在ARW742L的细胞中没有观察到细胞增殖(图1K, 1L)。研究表明ART878A或ARH875Y患者可能对孕酮的致癌作用更敏感。
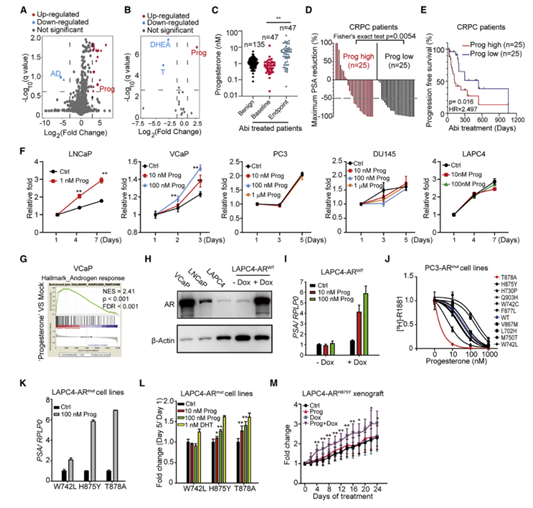
图1 孕酮通过AR具有短暂致癌作用
孕酮调控的非典型AR靶基因
VCaP细胞的转录组分析显示孕酮和双氢睾酮(DHT)对几条通路有不同的调节作用,孕酮治疗后表明前列腺癌侵袭性的基因标记都有所增加,但DHT治疗后没有增加(图2A, 2B)。孕酮上调最重要通路通路被DHT抑制,AR参与其中(图2C, 2D)。这些孕酮激活但DHT抑制的基因视为非经典AR靶基因,非典型AR靶基因表达活跃的患者治疗持续时间较短;孕酮对非经典AR靶基因有调控作用, 敲除这些基因抑制了VCaP细胞的增殖(图2E-2G)。以上研究表明孕酮通过对典型靶基因和非典型靶基因的调控,通过AR促进前列腺癌的进展。
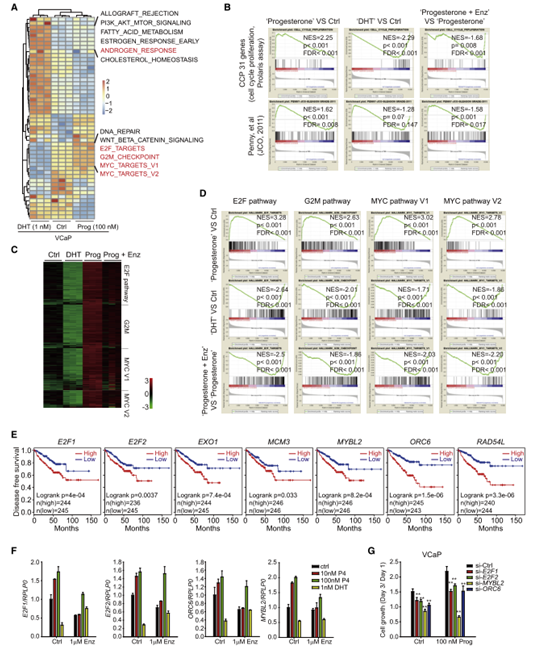
图2 受孕酮调控的非经典AR靶基因
孕酮在生理水平上的致癌作用
分别用5 nM孕酮或乙醇处理LAPC4细胞生成Prog细胞和Ctrl细胞,Prog细胞表现出比Ctrl细胞更强的增殖能力(图3A)。转录组分析显示,Prog细胞中雌激素反应通路被激活,而雄激素受体(AR)、雌激素受体1 (ESR1)和孕酮受体(PR)的表达没有改变(图3B, 3C)。使用不同的数据库对这些参与雌激素反应途径的基因进一步分析发现,这些基因在前列腺癌中频繁扩增,并随着疾病的进展表达增加,这些基因的高表达与较差的临床结果相关(图3D)。Prog细胞的qPCR进一步证实了参与雌激素反应途径的基因活跃表达,敲除这些基因抑制了细胞的增殖(图3E, 3F)。总而言之,生理水平的孕酮在前列腺癌中具有累积的致癌效应。
作者通过多种方式筛选到了具有潜在致癌效应的转录因子GATA2 (Figure3G)。GATA2的高表达不仅与癌症治疗失败正相关,与参与雌激素反应途径的基因正相关,在Prog细胞中mRNA和蛋白表达水平的GATA2也增加;而敲除GATA2基因会影响雌激素反应途径基因的表达(Figure3H, 3I, 3M)。GATA2的抑制剂K7174抑制了Prog细胞中雌激素反应途径相关基因的表达; K7174在Prog细胞中调节基因表达的作用比在Ctrl细胞中更显著,也会抑制Prog细胞的快速增殖(图3J-3L)。敲除GATA2基因对基因表达和细胞增殖的影响在Prog细胞中更为明显(图3N, 3O)。转录组分析还显示,针对GATA2的siRNAs抑制了Prog细胞的雌激素反应途径(图3P)。从Prog细胞产生的异种移植比从Ctrl细胞产生的异种移植生长更快,K7174特异性抑制Prog_细胞诱导的异种移植瘤生长(图3Q)。以上研究表明,GATA2介导了孕酮累积的致癌效应,是前列腺癌治疗的潜在靶点。
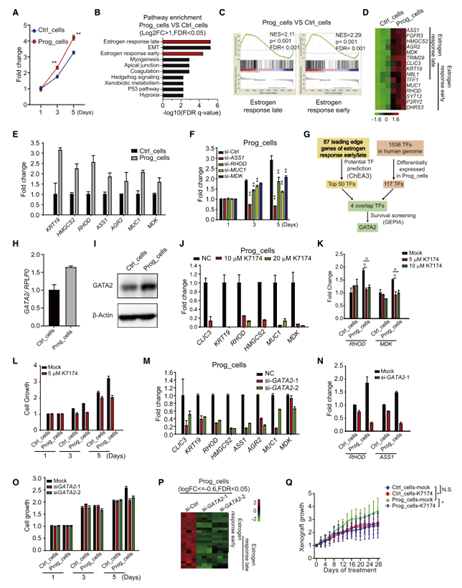
图3 孕酮通过GATA2累积的致癌效应
靶向孕酮代谢阻断孕酮的致癌作用
既往研究表明胆固醇产生的孕烯醇酮转化为孕酮,进一步转化为5α孕酮(5αP)、5β孕酮(5βP)以及相关的下游代谢物,利用3H孕烯醇酮在前列腺活检样本中证实了这一代谢途径(图4A, 4B)。研究服用阿比特龙患者血浆孕酮相关代谢产物的分布发现,孕烯醇酮、孕酮、5αP是患者体内的主要代谢物,大多数代谢物激活LNCaP和VCaP细胞AR靶基因的表达;孕酮和5αP结合到AR的配体结合域,其对AR的亲和力最强,孕烯醇酮对野生型AR和ART878A突变体的结合亲和力有限(图4C, 4D)。因此,孕烯醇酮的致癌作用可能源于其转化为孕酮,这一假设在小鼠组织中得到验证,孕烯醇酮并不像孕酮那样促进前列腺类器官的形成,不能激活小鼠前列腺器官中的AR信号(图4E-4H)。这些数据表明,抑制孕烯醇酮向孕酮的转化是前列腺癌治疗的潜在策略。
肾上腺不是孕烯醇酮和孕酮的唯一来源,前列腺周脂肪组织也可能通过旁分泌机制为前列腺癌细胞提供类固醇。前列腺癌根治术患者脂肪组织分泌物激活AR靶基因证实了该观点,在激活AR脂肪细胞组织的分泌物中检测到明显更高浓度的孕烯醇酮 (图4I, 4J)。由此可见,孕烯醇酮的疗效并不局限于阿比特龙治疗的患者。

图4 孕酮相关代谢产物在前列腺癌中的作用
结合孕酮代谢途径分析,类固醇生成酶3βHSD1是一个潜在靶点,可抑制孕烯醇酮向孕酮的转化。结合既往研究发现,补骨脂宁(Corylin)呈剂量依赖性地抑制DHEA向AD的转化,Corylin的衍生物Bichanin A(BCA)是最有效的3βHSD1抑制剂(图5A-5C)。通过细胞热位移分析确定BCA和3βHSD1之间的潜在相互作用,BCA增加了3βHSD1的热稳定性,BCA探针证实了其抑制3βHSD1活性的功能(图5D-5F)。谷胱甘肽S-转移酶(GST)-3βHSD1与BCA探针结合,加入DHEA或BCA会阻止这种结合作用,BCA与DHEA竞争结合底物识别口袋3βHSD1(图5G, 5H)。对参与BCA结合的3βHSD1的必需氨基酸进行突变验证酶活,E126在识别BCA发挥了重要作用,E126A突变体完全损害了BCA的功能(图5I)。BCA特异性抑制DHEA,但不抑制DHT诱导的AR靶基因表达(图5J)。研究表明BCA可有效抑制3βHSD1的活性,抑制孕酮生成。
用孕烯醇酮和BCA共同作用于稳定表达Dox诱导3βHSD1的VCaP细胞系,3βHSD1过表达可促进孕烯醇酮向孕酮的转化,而BCA可抑制孕烯醇酮向孕酮的转化(图5K)。BCA成功抑制了孕烯醇酮诱导的VCaP和LNCaP细胞的基因表达和细胞增殖,但对孕酮没有影响,BCA抑制了孕烯醇酮但不是黄体酮-持续的异种移植发展(图5L-5O)。总之,抑制孕酮的合成是阻断孕酮致癌作用的可行策略。
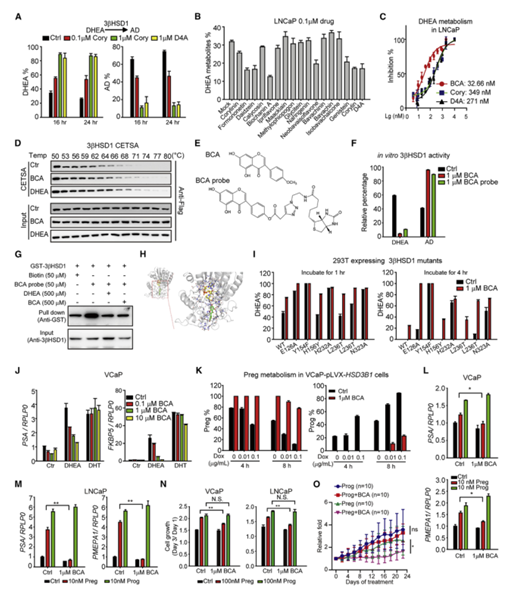
图5 BCA作为3βHSD1的抑制剂可消除孕酮的致癌作用
孕酮作为阿比特龙疗效的预测生物标志物
临床试验发现在阿比特龙治疗3个月后,17名CRPC患者的血浆孕酮水平升高;观测终点血浆孕酮水平较高的患者,在阿比特龙治疗3个月后血浆孕酮水平也较高(图6A, 6B)。阿比特龙治疗3个月后血药浓度>3 nM的患者,阿比特龙治疗持续时间较短(图6C)。临床上常用阿比特龙治疗3个月后PSA下降来评价疗效,有11名患者的PSA较基线水平下降了50%以上,PSA下降较明显的患者在阿比特龙治疗3个月后血浆孕酮浓度较低(图6D, 6E)。简而言之,服用阿比特龙的患者血浆孕酮水平早期升高,血浆孕酮水平作为阿比特龙治疗反应的预测生物标志物对预后有预测作用。
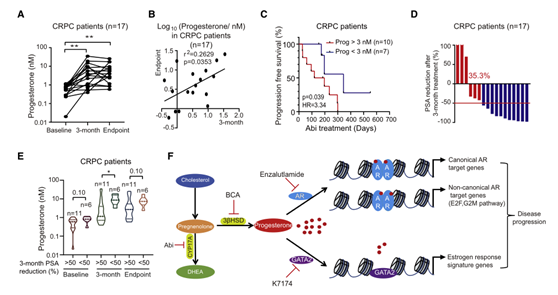
图6 孕酮作为阿比特龙治疗应答的预测性生物标志物
总结
-
雄激素以外的代谢物可能会推动前列腺癌的进展,作者利用UHPLC-MS技术对患者血浆代谢物进行筛选并结合临床数据回顾分析,发现孕酮是前列腺癌的致癌激素。
-
明确孕酮通过对典型靶基因和非典型靶基因的调控,通过AR促进前列腺癌的进展。
-
转录因子GATA2介导了孕酮累积的致癌效应,是前列腺癌治疗的潜在靶点。
-
抑制孕烯醇酮向孕酮的转化是前列腺癌治疗的潜在策略, Bichanin A(BCA)可有效抑制类固醇生成酶3βHSD1的活性,抑制孕酮生成阻断孕酮致癌作用。
-
血浆孕酮水平升高与阿比特龙治疗患者的不良临床结果相关,血浆孕酮水平可作为阿比特龙治疗反应的预测生物标志物。



