文献分享丨Nat Rev Cancer肿瘤代谢:展望未来

肿瘤代谢是近年来肿瘤生物学研究的热点之一,肿瘤细胞中受调控的代谢改变包括有氧糖酵解(Warburg效应)、葡萄糖摄取量增加、谷氨酰胺代谢异常活跃、利用非主要供能物质供能等,这些改变满足了肿瘤细胞快速增殖时旺盛的能量和物质需求,帮助细胞适应缺氧的肿瘤微环境,进而为肿瘤的增殖、侵袭、迁移等生物活动提供能量和物质支持。
肿瘤发生和发展需要肿瘤细胞的代谢重编程。美国西北大学Navdeep Chandel团队全面概况了肿瘤代谢领域的最新研究进展,并梳理了本领域中尚未解决的关键问题,综述文章“Cancer metabolism: looking forward”于2021年7月发表在Nature reviews cancer上。
历史梳理
1921年德国科学家Otto Warburg观察到一种奇怪的现象:肿瘤细胞的糖酵解异常活跃,即使在氧气充足的条件下,肿瘤细胞也倾向于将葡萄糖“发酵”成乳酸。他个人也因为发现细胞呼吸氧化转移酶而获得了1931年的诺奖。Warburg最初猜测肿瘤细胞的线粒体存在发育缺陷,从而导致有氧呼吸功能受损,故而依赖于糖酵解代谢。但是,随后的研究表明,大多数肿瘤细胞中线粒体功能并未受损,表明肿瘤细胞的有氧糖酵解存在其他解释。20世纪90年代,人们认识到参与糖酵解的乳酸脱氢酶A(LDHA)是癌基因MYC的转录靶点,这为Warburg效应提供了分子基础。此外,同期还发现了AKT、mTOR和HIF的失调,这些也是肿瘤生存和生长所必需的。这些途径分别通过葡萄糖转运蛋白和糖酵解酶的转录上调和磷酸化来增加糖酵解。
在本世纪初,大部分的研究工作都集中在Warburg效应的机制研究,为什么它有利于肿瘤的生长?一种解释是通过增加糖酵解,糖酵解的中间产物可以进入合成代谢通路去支持核苷酸、脂类、氨基酸的合成从而使细胞增殖。另一种新的解释是TCA循环理论,一个关键的证据是通过肿瘤细胞中的电子传递链(ETC)基因工程来发现的,保持ETC相关的TCA循环功能完好,但通过氧化磷酸化破坏了ETC相关的ATP生成,肿瘤仍然在活体内生长,这表明来自糖酵解的ATP可以支持原发性肿瘤生长。此外,丙酮酸羧化酶(PC)使丙酮酸生成TCA循环代谢产物草酰乙酸,也被证明是原发性和转移性肿瘤生长所必需的物质。草酰乙酸产生的天冬氨酸及其衍生物天冬酰胺都可以抑制肿瘤生长。此外,氧化代谢产生的活性氧(ROS)可以导致肿瘤发生,但需要严格调节,不致引起细胞死亡。这篇文章并不是为了提供关于肿瘤代谢重要领域的所有研究的详细信息,而是提供了一个视角,描绘了共性主题和关键问题。
合成代谢与肿瘤生长
产生两个子细胞需要细胞增殖过程中的大分子(例如核苷酸和脂质)。肿瘤细胞可从血液循环中获得其它细胞合成的大分子。两个关键问题是:1)肿瘤生长过程的限速大分子是哪些?2)维持肿瘤生长要调用哪些胞内途径?这些过程可能取决于从肿瘤微环境(TME)中。在特定条件下,脂质可能从微环境中获得,而在其他情况下,癌细胞可能需要从头合成脂质(图1)。
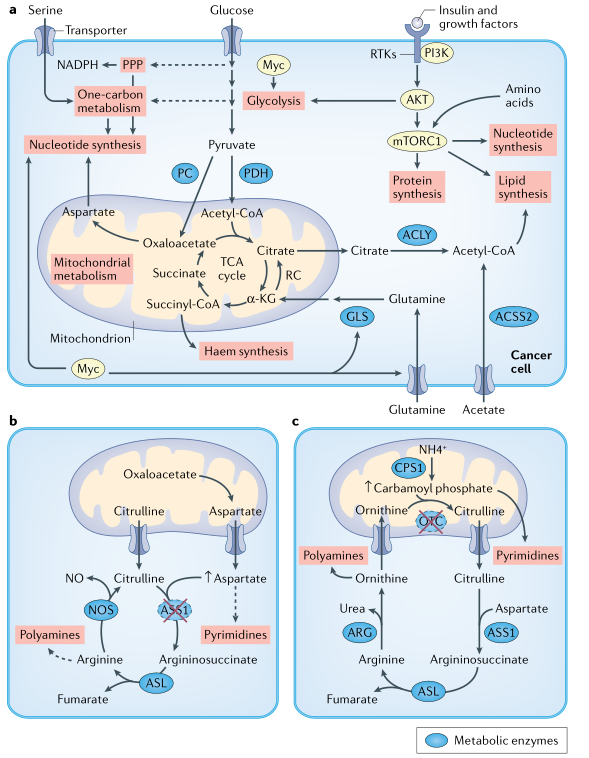
图1支持肿瘤产生的的代谢物和信号通路
信号通路
肿瘤细胞如何选择信号通路和转录网络(例如PI3K-AKT-mTORC1和MYC)通过增加代谢通量来维持细胞增殖?mTORC1通路已成为营养供给的中心节点,通过加强细胞中的蛋白质合成、脂质合成和核苷酸合成等途径来满足细胞增殖的物质基础。
作为信号分子的代谢物
在一些肿瘤中由于发生琥珀酸脱氢酶(SDH)、延胡索酸水合酶(FH)、异柠檬酸脱氢酶1或2(IDH1/IDH2)基因突变,对应的下游代谢物琥珀酸、延胡索酸和2-羟基戊二酸(2HG)的水平大幅增加,从而导致不同肿瘤的发生,这些代谢物甚至被称为“肿瘤代谢物”(图2)。例如,SDH突变常见于遗传性副神经节瘤、嗜铬细胞瘤和胃肠道间质瘤,而FH突变可导致遗传性平滑肌瘤病和肾细胞癌,IDH1/IDH2突变可导致胆管癌、软骨肉瘤、胶质瘤和急性髓系白血病。要注意的是,SDH和/或FH突变的肿瘤细胞中仍然能够生成TCA循环代谢物,供肿瘤细胞生长所需。琥珀酰辅酶A用于血红素合成,草酰乙酸用于核苷酸合成。因此,必须进行代谢重编程以适应这些突变,来确保合成肿瘤细胞增殖所需的大分子(血红素和核苷酸)。

图2癌症代谢的信号和非典型机制
活性氧与肿瘤进展
肿瘤细胞产生的主要活性氧(ROS)是超氧化物(O2-)、过氧化氢(H2O2)、羟基自由基(-OH)和脂质过氧化氢(LOOH)。H2O2主要是一种信号分子,可以通过氧化还原信号促进癌细胞增殖、存活和侵袭,也可通过过氧化物酶分解为水。但其他形式的活性氧,如LOOH、-OH和O2-可导致蛋白质、脂质、线粒体和核DNA被氧化从而产生毒性甚至铁死亡(图3)。在稳定状态下,任何类型ROS的水平取决于ROS产生速率与ROS清除速率。肿瘤细胞中ROS的生成率比正常细胞高得多,而胰腺癌研究表明限制ROS水平是肿瘤细胞发生的必要条件,而维持ROS水平则会促进肿瘤的转移。这些结论看似矛盾。
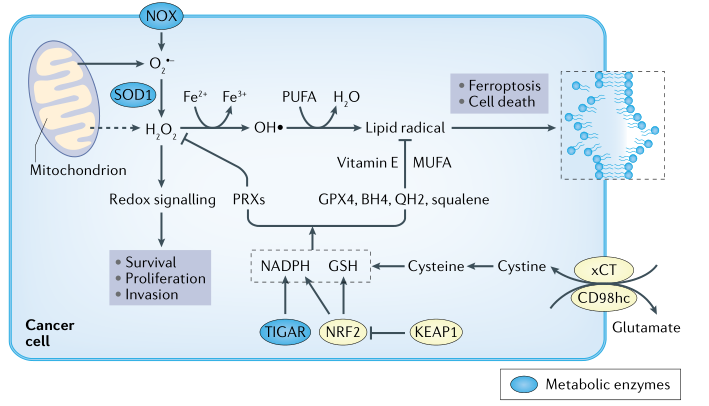
图3肿瘤细胞中的ROS
营养有效性
在肿瘤发展过程中,实体肿瘤内营养物质的可及性经常受到其邻近脉管系统和组织结构的影响。与正常血管不同,肿瘤脉管的不规则分支,会导致输送的营养参差不齐,并导致TME内的营养差异性。自噬是当营养缺乏或生长因子不足时,细胞存活和增殖的关键途径之一(图4)。
TME代谢
除了营养供应和酸性条件的改变外,体内TME的一个特点是其由不同类型的细胞组成,有助于调控肿瘤进展。一个简单的模型是:内皮细胞和基质细胞支持肿瘤生长,而细胞毒性T细胞(CTLs)则抑制肿瘤进展。主要碳代谢通路如单碳代谢、糖酵解和TCA循环不仅是癌细胞增殖的必要条件,而且对内皮细胞、基质细胞、CTLs、调节性T细胞和髓系细胞的功能也至关重要。因此,肿瘤细胞必须与TME中的其他各种细胞争夺营养。例如,由于其转运体(SLC43A2)水平的增加,肿瘤细胞对蛋氨酸的消耗量增加,从而限制了CTL中的蛋氨酸循环,导致组蛋白被甲基化修饰从而导致CTL功能受损。通常认为氧和葡萄糖会限制体内肿瘤的生长。然而,在低至0.5%的氧气水平下线粒体有氧呼吸依旧工作,在低至0.5 mM的葡萄糖浓度下肿瘤细胞依旧可以增殖。TME中的低氧和低葡萄糖水平可能不会限制代谢本身,而是影响基因表达的变化(例如HIF的激活),从而改变代谢适应所必需的信号通路。然而,某些氨基酸可能限制TME内的代谢,包括精氨酸、色氨酸、丙氨酸、丝氨酸和甘氨酸,这些氨基酸不仅是肿瘤细胞增殖所必需的,也是CTL功能所必需的。
除了营养竞争外,TME中不同类型细胞之间也存在代谢串扰,使得肿瘤细胞可以在不利条件下生长。例如,在胰腺肿瘤中,基质相关胰腺星状细胞和肿瘤相关成纤维细胞可分别提供丙氨酸和谷氨酰胺等碳源,以支持肿瘤细胞中的TCA循环代谢。此外,上皮性卵巢癌细胞周围的脂肪细胞为肿瘤发展提供脂肪酸。相反,癌细胞通过各种机制逃避CTL介导的杀伤,包括释放代谢产物如犬尿氨酸和乳酸,这些代谢产物可增强调节性T细胞和髓系细胞依赖性免疫抑制功能。最后,慢性抗原刺激和免疫抑制受体,如PD1,也会导致TME中T细胞的代谢损伤。目前,我们还不能完全理解TME内不同细胞之间代谢串扰。目前研究体内肿瘤代谢的一个限制是无法确定检测到的代谢是来自癌细胞还是TME内的其他细胞?因此,呼唤新检测技术来评估这种代谢异质性。
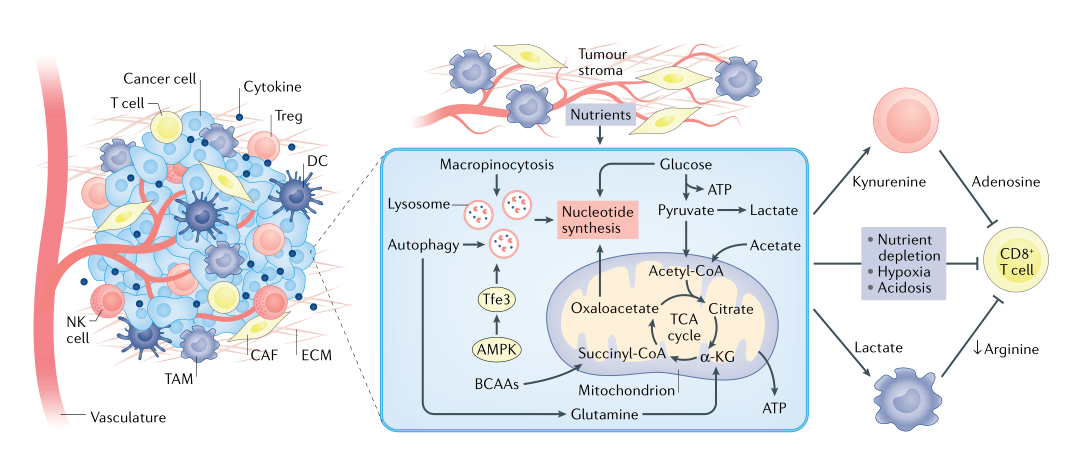
图4 TME内细胞的代谢串扰
转移的代谢调控
在过去的几年里,肿瘤代谢研究的一个新兴领域是转移研究,这是癌症患者死亡的一个主要因素。转移是一个将原发肿瘤细胞扩散到继发部位的低效过程,代谢限制现在被认为是肿瘤细胞转移潜能的障碍。代谢变化与转移过程中的每一个连续的多步骤过程相关联:基底膜的侵袭和细胞迁移到周围的血管或淋巴系统(即体内浸润);在循环中生存;血管外渗和继发性肿瘤部位的定植。
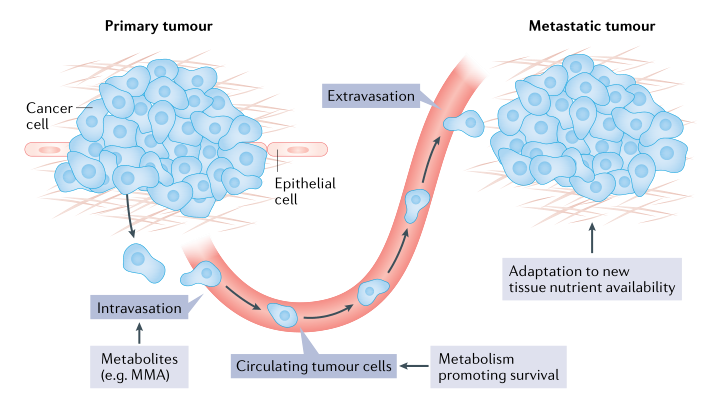
图5肿瘤转移的多步骤代谢调节
靶向代谢治疗
最开始,代谢酶是肿瘤症治疗中有吸引力的治疗靶点,但由于多种原因,针对代谢物的新药很少。核苷类似物是第一批用于癌症治疗的药物,然而进一步研究发现,它们不仅影响肿瘤细胞,也影响正常的增殖细胞。同样,由于对正常组织的毒性,靶向其他代谢物或代谢酶的治疗也受到了限制。
后面,通过控制饮食中的丝氨酸或蛋氨酸以及生酮来调节肿瘤进展的研究又浮现出来。例如,在胰腺癌、子宫内膜癌、膀胱癌和乳腺癌以及急性髓系白血病的小鼠模型中,胰岛素可有效激活PI3K信号通路,生酮饮食或SGLT2抑制剂可提高PI3K抑制剂的疗效,这两种抑制剂都可降低胰岛素水平。此外,肥胖与某些癌症的发病率之间存在联系。在小鼠模型中,给予高脂饮食会增加原发性肿瘤的生长和转移。富含MUFA的饮食可能没有益处,因为它们可能能够防止铁死亡,从而潜在地增加肿瘤生长和转移风险。
二甲双胍通过抑制线粒体复合物I和调节肿瘤免疫被用于肿瘤预防和治疗。二甲双胍治疗后可降低细胞内天冬酰胺水平,并且通过添加天冬酰胺酶,可减少胞外天冬酰胺水平,从而加强药物在小鼠肿瘤模型中的疗效。有趣的是,一项研究表明乳腺癌细胞内天冬酰胺的可用性决定了肿瘤的转移潜力。我们推测,有机阳离子转运蛋白(OCTs)高表达可能是二甲双胍和天冬酰胺酶对肿瘤治疗有效的前提。总的来说,这些研究表明,靶向代谢治疗需要“个性化医疗”方法来定义正确的肿瘤细胞和机体代谢目标,并结合遗传机制和护理标准治疗(图6)。
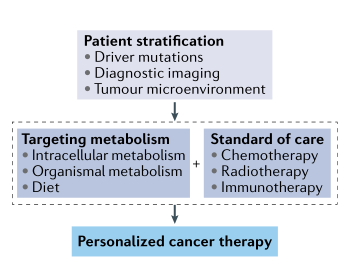
图6针对肿瘤代谢的个性化医疗方法
总结
肿瘤代谢已经从Warburg效应的简单模型发展到目前对肿瘤代谢的巨大复杂性的研究,未来还有若干关键问题需要解决。现在已经认识到TME施加的代谢限制和TME内不同的细胞组成如何影响肿瘤进展。应用相关技术能使人们能够发现新的代谢蛋白,发现肿瘤细胞在肿瘤起始、进展和转移过程中所使用的新途径。代谢水平变化是如何增加患癌风险的,这依旧是一个尚未完全清晰的领域,在未来几年可能会蓬勃发展。一些源自肿瘤代谢研究的技术和想法,已经对新兴领域的免疫代谢、干细胞代谢和有机体代谢产生了影响。在接下来的十年里,小分子代谢物,这一曾沦为现代分子生物学和遗传学背景板的冷门选手,将继续在生理学和病理学的机制研究中发挥积极作用。毕竟,在过去的几十年里,那些对人类健康和疾病产生巨大影响的药物,包括他汀类药物、二甲双胍和最近的SGLT2抑制剂,都是针对小分子代谢物的。



